题目内容
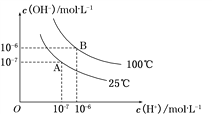
【题目】(1)一定条件下,在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示。100 ℃时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=__________。
(2)pH=3的盐酸与pH=5的盐酸等体积混合,pH=_________。
(3)25℃时,在0.5L0.2mol/L的HA溶液中,有0.02mol的HA电离成离子,则该温度下的电离常数为_____________。
【答案】2×10-9 mol·L-1 3.3 0.01
【解析】
(1)由图中信息可知,100 ℃时,c(H+)=c(OH-)= 10-6 mol/L,Kw= c(H+) c(OH-)= 10-12 mol2/L2,由水电离产生的c(H+)等于溶液中氢氧根离子浓度,则盐酸中c(H+)=5×10-4 mol·L-1,即c(H+)水=c(OH-)=![]() =
=![]() =2×10-9 mol·L-1;(2)①pH=3和pH=5的两种盐酸溶液等体积混合,则c(H+)=
=2×10-9 mol·L-1;(2)①pH=3和pH=5的两种盐酸溶液等体积混合,则c(H+)=![]() ≈0.0005mol/L,所以pH = -lgc(H+) = -lg0.0005 = 4 - lg5 = 4 - 0.7 = 3.3;(3)在0.5L0.2mol/L的HA溶液中,有0.02mol的HA电离成离子,即n(A-)=n(H+)=
≈0.0005mol/L,所以pH = -lgc(H+) = -lg0.0005 = 4 - lg5 = 4 - 0.7 = 3.3;(3)在0.5L0.2mol/L的HA溶液中,有0.02mol的HA电离成离子,即n(A-)=n(H+)=![]() =0.04mol/L,则K=
=0.04mol/L,则K=![]() =
=![]() =0.01。
=0.01。

练习册系列答案
相关题目