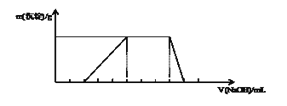
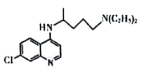
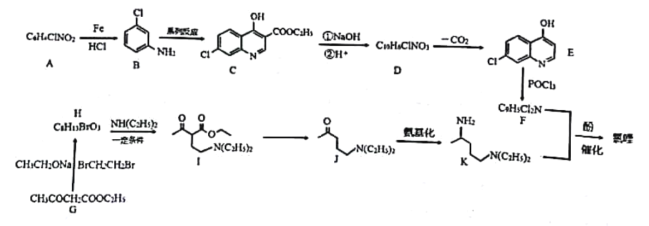
题目内容
【题目】某化学小组为研究SO2的化学性质并探究与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持,加热装置已略,气密性已检验)

实验操作和现象如下:
(1)关闭活塞K2,K3,打开活塞K1,向A中滴加一定量的浓硫酸并加热,A中有白雾生成,铜片表面产生气泡。
(2)当C出现明显现象后,关闭K1,并停止加热。
①写出A中发生反应的化学反应方程式______;
②B装置的作用是_____;
③C中的现象为__;
(3)打开活塞K2,再向A中滴加一定量的浓硫酸并加热,D中有气泡冒出,产生少量白色沉淀,E中产生白色沉淀,液面上方略显浅棕色并逐渐消失;
(4)从D、E中分别取少量白色沉淀,加稀盐酸,白色沉淀不溶解。
①分析D中产生不溶于稀盐酸的沉淀的原因____;
②为了证实上述分析是否正确,在原实验基础上,在打开活塞K2之后增加一步操作,该操作是___;
(5)增加以上操作后,重复实验步骤(3),D中无沉淀生成,而E中仍产生白色沉淀,用离子方程式解释E中仍有白色沉淀的原因__。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 除去SO2中的H2SO4 石蕊试液变红 仪器中残留的氧气氧化了H2SO3 打开K3,通入N2一段时间 3H2SO3+2NO3—+3Ba2+=3BaSO4↓+2NO↑+4H++H2O
CuSO4+SO2↑+2H2O 除去SO2中的H2SO4 石蕊试液变红 仪器中残留的氧气氧化了H2SO3 打开K3,通入N2一段时间 3H2SO3+2NO3—+3Ba2+=3BaSO4↓+2NO↑+4H++H2O
【解析】
由实验装置图可知,装置A中浓硫酸与铜片共热反应生成二氧化硫,二氧化硫的白雾中混有硫酸,装置B用于除去二氧化硫中混有的硫酸;二氧化硫与水反应生成亚硫酸,使溶液呈酸性,C装置中石蕊试液变红色,二氧化硫与氯化钡溶液不反应,装置D中无白色沉淀生成,二氧化硫与水反应生成亚硫酸,使溶液呈酸性,酸性条件下,硝酸根将亚硫酸氧化生成硫酸,硫酸与与氯化钡溶液反应生成硫酸钡,装置E中有白色沉淀生成。
(2)①A中浓硫酸与铜片共热反应生成硫酸铜、二氧化硫和水,反应的化学反应方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②装置A中产生的白雾中混有硫酸,能与会氯化钡溶液反应生成硫酸钡白色沉淀,会干扰二氧化硫性质的验证,则B装置的作用是用亚硫酸氢钠溶液除去硫酸,排出干扰二氧化硫性质的验证,故答案为:除去SO2中的H2SO4;
③二氧化硫与水反应生成亚硫酸,使溶液呈酸性,能使C装置中石蕊试液变红色,故答案为:石蕊试液变红;
(4)①E中产生白色沉淀,液面上方略显浅棕色并逐渐消失说明装置中仪器中残留氧气,二氧化硫与氯化钡溶液不反应,装置D中产生不溶于稀盐酸的白色沉淀,说明仪器中残留氧气将亚硫酸氧化生成硫酸,硫酸与与氯化钡溶液反应生成硫酸钡,故答案为:仪器中残留的氧气氧化了H2SO3;
②为排出仪器中残留氧气的干扰,在打开活塞K2之后,打开K3,通入氮气一段时间,排尽仪器中的氧气,故答案为:打开K3,通入N2一段时间;
(5)E中产生白色沉淀的原因是二氧化硫与水反应生成亚硫酸,使溶液呈酸性,酸性条件下,硝酸根将亚硫酸氧化生成硫酸,硫酸与与氯化钡溶液反应生成硫酸钡,反应的离子方程式为3H2SO3+2NO3—+3Ba2+=3BaSO4↓+2NO↑+4H++H2O,故答案为:3H2SO3+2NO3—+3Ba2+=3BaSO4↓+2NO↑+4H++H2O。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案