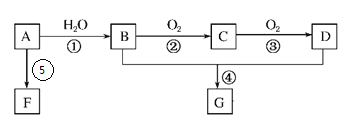
题目内容
【题目】下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++![]() =BaSO4↓
=BaSO4↓
【答案】A
【解析】
A.向氯化铁溶液中加入铁粉,Fe3+被Fe还原为Fe2+,溶液的颜色变浅,发生反应的离子方程式为:2Fe3++Fe=3Fe2+,A正确;
B.向碳酸氢钠溶液中滴加稀盐酸,溶液中![]() 与H+发生反应,生成CO2气体等,反应的离子方程式为:
与H+发生反应,生成CO2气体等,反应的离子方程式为:![]() +H+=CO2↑+H2O,B不正确;
+H+=CO2↑+H2O,B不正确;
C.向稀硝酸溶液加入少量锌粉,由于硝酸是氧化性酸,所以Zn、H+、![]() 发生氧化还原反应,没有H2产生,C不正确;
发生氧化还原反应,没有H2产生,C不正确;
D.向氢氧化钡溶液中滴加稀硫酸,生成硫酸钡沉淀的同时,有水生成,反应的离子方程式为:Ba2+ + 2OH-+ 2H++ ![]() = BaSO4↓+ 2H2O,D不正确;
= BaSO4↓+ 2H2O,D不正确;
故选A。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
选项 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br>I |
A. A B. B C. C D. D
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
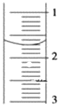
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度