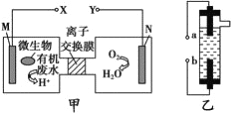
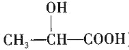
题目内容
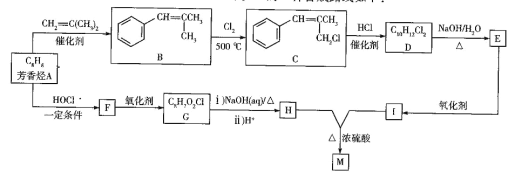
【题目】研究发现艾滋病治疗药物利托那韦对新型冠状病毒也有很好的抑制作用,它的合成中间体2-异丙基-4-(甲基氨基甲基)噻唑可按如下路线合成:
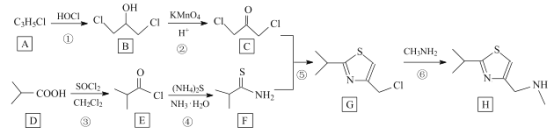
回答下列问题:
(1)A的结构简式是__________,C中官能团的名称为 ______________。
(2)①、⑥的反应类型分别是__________、_____。D的化学名称是______。
(3)E极易水解生成两种酸,写出E与NaOH溶液反应的化学方程式:_______。
(4)H的分子式为 __________________。
(5)I是相对分子质量比有机物 D 大 14 的同系物, 写出I 符合下列条件的所有同分异构体的结构简式:_____________。
①能发生银镜反应 ②与NaOH反应生成两种有机物
(6)设计由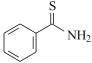 ,和丙烯制备
,和丙烯制备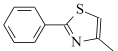 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
【答案】CH2=CH-CH2Cl 羰基、氯原子 加成反应 取代反应 2-甲基丙酸 ![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O C8H14N2S HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3
+NaCl+H2O C8H14N2S HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3 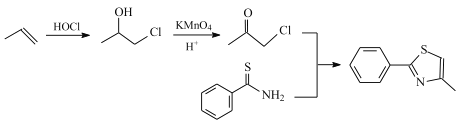
【解析】
根据合成路线中,有机物的结构变化、分子式变化及反应条件分析反应类型及中间产物;根据目标产物及原理的结构特征及合成路线中反应信息分析合成路线;根据结构简式、键线式分析分子式及官能团结构。
(1)根据B的结构及A的分子式分析知,A与HOCl发生加成反应得到B,则A的结构简式是CH2=CH-CH2Cl;C中官能团的名称为羰基、氯原子;故答案为:CH2=CH-CH2Cl;羰基、氯原子;
(2)根据上述分析,反应①为加成反应;比较G和H的结构特点分析,G中氯原子被甲胺基取代,则反应⑥为取代反应;D为![]() ,根据系统命名法命名为2-甲基丙酸;故答案为:加成反应;取代反应;2-甲基丙酸;
,根据系统命名法命名为2-甲基丙酸;故答案为:加成反应;取代反应;2-甲基丙酸;
(3)E水解时C-Cl键发生断裂,在碱性条件下水解生成两种盐,化学方程式为:![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O,故答案为:
+NaCl+H2O,故答案为:![]() +2NaOH→
+2NaOH→![]() +NaCl+H2O;
+NaCl+H2O;
(4)H的键线式为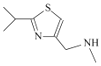 ,则根据C、N、S原子的成键特点分析分子式为C8H14N2S,故答案为:C8H14N2S;
,则根据C、N、S原子的成键特点分析分子式为C8H14N2S,故答案为:C8H14N2S;
(5)I是相对分子质量比有机物 D 大14 的同系物,则I的结构比D多一个CH2原子团;①能发生银镜反应,则结构中含有醛基;②与NaOH反应生成两种有机物,则该有机物为酯;结合分析知该有机物为甲酸某酯,则I结构简式为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3,故答案为:HCOOCH2CH2CH2CH3、HCOOCH2CH(CH3)2、HCOOCH(CH3)CH2CH3、HCOOC(CH3)3;
(6)根据合成路线图中反应知,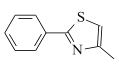 可由
可由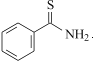 与
与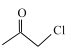 合成得到,
合成得到, 由
由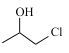 氧化得到,
氧化得到, 可由丙烯加成得到,合成路线为:
可由丙烯加成得到,合成路线为: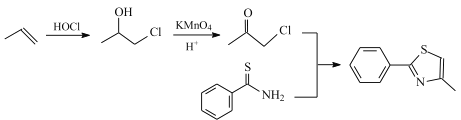 ,故答案为:
,故答案为: 。
。

【题目】Ⅱ组命题正确且能用I组命题加以解释的是( )
选项 | I组 | Ⅱ组 |
A |
|
|
B |
|
|
C |
|
|
D |
|
|
A.AB.BC.CD.D
【题目】SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
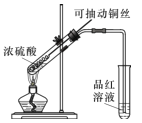
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
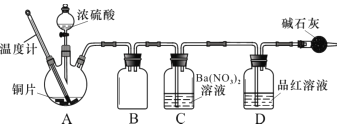
实验记录 A 中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。