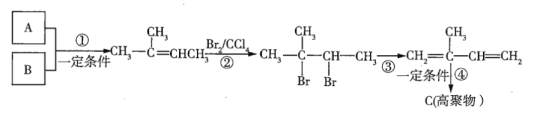
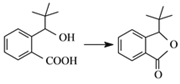
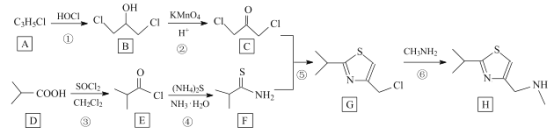
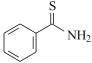
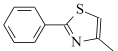
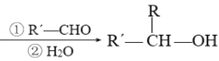题目内容
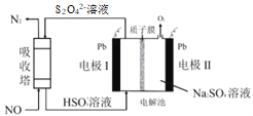
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
【答案】C
【解析】
A. 电池放电时,是原电池的工作原理,a电极为正极,得电子发生还原反应,反应为 Fe 3++e- =Fe2+,故A正确;
B. 充电时是电解池工作原理,b电极为阴极,得电子发生还原反应,反应为 Cr3++e- =Cr2+,故B正确;
C. 原电池在工作时,阳离子向正极移动,所以放电过程中H+通过隔膜从负极区移向正极区,故C错误;
D. 根据电池构造分析,该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低,故D正确;
故选C。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】某学生用0.2000molL-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数请回答:
(1)以上步骤有错误的是___(填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___(从图中选填“甲”或“乙”)中。
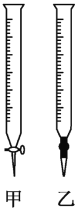
(3)下列操作会引起实验结果偏大的是___(填编号)。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视___。判断到达滴定终点的现象是:锥形瓶中溶液___。
(5)以下是实验数据记录表:
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通过计算可得,该盐酸浓度为___ molL-1(计算结果保留4位小数)。