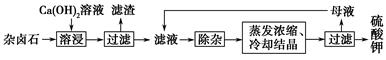
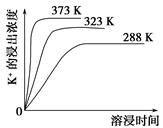
题目内容
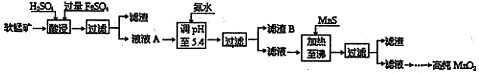
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: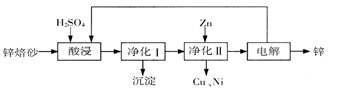
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃,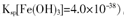 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
(1)ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①H2O2+2Fe2++2H+═2Fe3++2H2O;②4.0×10-5mol/L;③Fe(OH)3胶体具有吸附性;(3)电解制取的锌中会含有铜等杂质;
(4)H2SO4、ZnSO4。
解析试题分析:(1)根据题给信息知,酸浸时ZnFe2O4会生成两种盐硫酸锌、硫酸铁,即ZnFe2O4与硫酸反应生成硫酸锌、硫酸铁和水,化学方程式为:ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O;(2)①亚铁离子被双氧水氧化成铁离子,离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O;②氢氧化铁的溶度积
Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=4.0×10-38/(1×10-11)3=4.0×10-5mol/L;③由于生成的Fe(OH)3胶体具有吸附性,所以净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质;(3)由于锌焙砂中含有CaO、FeO、CuO、NiO等氧化物,反应后溶液中存在铜离子等杂质,没有净化Ⅱ操作,电解制取的锌中会含有铜等杂质;(4)通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有H2SO4、ZnSO4。
考点:以工业上利用锌焙砂制取金属锌的工艺流程为载体考查离子方程式、化学方程式的书写及沉淀溶解平衡的计算等知识,

孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物 开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物 完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。 Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?________。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________。
c(Na+)-c(A-)=________mol·L-1
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB-
 H++B2-。
H++B2-。回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)


 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O