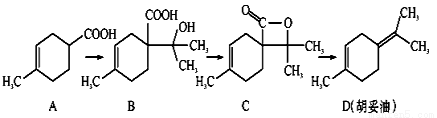
题目内容
17.如表有关实验现象、解释和结论都正确的一项是( )| 实验操作 | 实验现象 | 解释或结论 | |
| A | 加热(170℃)乙醇与浓硫酸混合物,将产生的气体直接通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫红色逐渐变浅 | 可能产生了SO2气体 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分为两层,下层是紫红色 | KI和氯水及苯发生反应 |
| C | 将少量SO2通入苯酚钠溶液中,振荡 | 溶液中出现浑浊 | 因为发生了反应: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把浓氨水加入到盛有Cu2O的试管中 | 溶液先无色,静置一段时间后变成蓝色 | Cu+被空气氧化成了Cu2+、使溶液显蓝色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓硫酸具有脱水性,C与浓硫酸发生氧化还原反应生成二氧化硫,且二氧化硫具有还原性;
B.先滴加氯水氧化碘离子生成碘,再加入少量苯,碘易溶于苯,苯的密度比水的密度小;
C.少量SO2通入苯酚钠溶液中,发生强酸制取弱酸的反应;
D.Cu2O可溶于浓氨水形成无色配合物,其在空气中被氧化为蓝色的配合物.
解答 解:A.浓硫酸具有脱水性,C与浓硫酸发生氧化还原反应生成二氧化硫,且二氧化硫具有还原性,则酸性高锰酸钾溶液紫红色逐渐变浅,可能产生了SO2气体,故A正确;
B.先滴加氯水氧化碘离子生成碘,再加入少量苯,碘易溶于苯,苯的密度比水的密度小,则溶液分为两层,上层是紫红色,且KI与苯不反应,故B错误;
C.少量SO2通入苯酚钠溶液中,发生强酸制取弱酸的反应,离子反应为2C6H5O-+SO2+H2O═2C6H5OH+SO32-,故C错误;
D.由现象可知Cu2O可溶于浓氨水形成无色配合物[Cu(NH3)4]2+,其在空气中被氧化为蓝色的[Cu(NH3)4(H2O)2)]2+,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、强酸制取弱酸、络合反应、氧化还原反应等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的综合考查,选项D为解答的难点,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
5.根据有机物的命名原则,下列命名正确的是( )
| A. | 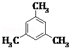 三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 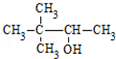 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
12.氯酸是一种强酸,常温下浓度超过40%时会发生分解,反应可表示为:aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
2.关于下列说法错误的是( )
| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |
9.下列叙述不正确的是( )
| A. | 因为氯气具有酸性,所以可与烧碱或石灰乳反应制备含氯消毒剂 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 | |
| C. | 过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:2 | |
| D. | 植物油的不饱和程度高于动物油,植物油更易氧化变质 |
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题: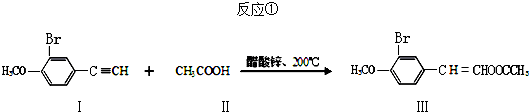
 (任写其中一种)
(任写其中一种)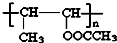 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.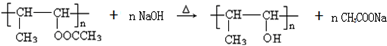 .利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式
.利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 .
.