题目内容
6.不饱和酯类化合物在药物、涂料等领域应用广泛.由炔烃直接制备不饱和酯的一种新方法如下: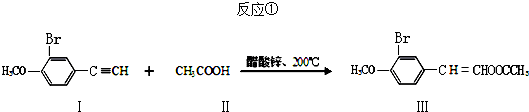
(1)下列有关化合物Ⅰ~Ⅲ的叙述中,正确的是AC.
A.化合物Ⅰ能使酸性高锰酸钾溶液和溴水褪色
B.化合物Ⅰ、Ⅱ、Ⅲ都能发生取代反应、加成反应、消去反应和加聚反应
C.化合物Ⅰ的所有碳原子可能都处于同一平面上
D.1mol化合物Ⅲ最多能与4molNaOH反应
(2)化合物Ⅲ的分子式为C11H11O3Br,1mol该化合物最多能与4molH2完全反应.
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,写出化合物Ⅳ结构简式
 (任写其中一种)
(任写其中一种)①能发生银镜反应,该化合物与银氨溶液反应的物质的量之比为1:4
②该化合物在与NaOH乙醇溶液共热能发生消去反应
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1
④该化合物遇到FeCl3溶液显紫色
(4)化合物Ⅴ是用于制备高聚物
 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.该高聚物完全水解的化学方程式为
 .利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式
.利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 .
.
分析 (1)A.I中含有苯环、碳碳三键、溴原子和醚键,具有炔烃、苯、卤代烃、醚的性质;
B.II中不含不饱和键,不能发生加成反应、加聚反应,I、II、III都不能发生消去反应;
C.苯、乙炔中所有原子都共面;
D.酯基水解生成的羧基能和NaOH反应,溴原子水解生成的酚羟基、HBr能和NaOH反应;
(2)化合物Ⅲ的分子式为C11H11O3Br,苯环、碳碳双键能和氢气发生加成反应;
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,
①能发生银镜反应,说明含有醛基,该化合物与银氨溶液反应的物质的量之比为1:4,说明含有两个醛基;
②该化合物在与NaOH乙醇溶液共热能发生消去反应说明连接溴原子的碳原子相邻碳原子上含有氢原子;
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1,说明有四种氢原子,且氢原子个数之比是6:2:2:1;
④该化合物遇到FeCl3溶液显紫色说明含有酚羟基;
据此判断同分异构体结构简式;
(4)化合物Ⅴ是用于制备高聚物 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3,该高聚物完全水解生成聚丙烯醇和醋酸钠;
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3,该高聚物完全水解生成聚丙烯醇和醋酸钠;
丙炔和乙酸在醋酸锌、200℃条件下发生加成反应生成CH2CHCHOOCCH3.
解答 解:(1)A.I中含有苯环、碳碳三键、溴原子和醚键,具有炔烃、苯、卤代烃、醚的性质,能和溴发生加成反应、能被酸性高锰酸钾溶液氧化,所以I能使溴水、酸性高锰酸钾溶液褪色,故A正确;
B.II中不含不饱和键,不能发生加成反应、加聚反应,I、II、III都不能发生消去反应,故B错误;
C.苯、乙炔中所有原子都共面,所以化合物Ⅰ的所有碳原子可能都处于同一平面上,故C正确;
D.酯基水解生成的羧基能和NaOH反应,溴原子水解生成的酚羟基、HBr能和NaOH反应,所以1mol化合物Ⅲ最多能与3molNaOH反应,故D错误;
故选AC;
(2)化合物Ⅲ的分子式为C11H11O3Br,苯环、碳碳双键能和氢气发生加成反应,所以1mol该化合物最多能与4molH2完全反应,故答案为:C11H11O3Br;4;
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,
①能发生银镜反应,说明含有醛基,该化合物与银氨溶液反应的物质的量之比为1:4,说明含有两个醛基;
②该化合物在与NaOH乙醇溶液共热能发生消去反应说明连接溴原子的碳原子相邻碳原子上含有氢原子;
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1,说明有四种氢原子,且氢原子个数之比是6:2:2:1;
④该化合物遇到FeCl3溶液显紫色说明含有酚羟基;
符合条件的同分异构结构简式为 ,
,
故答案为: ;
;
(4)化合物Ⅴ是用于制备高聚物 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3,该高聚物完全水解生成聚丙烯醇和醋酸钠,反应方程式为
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3,该高聚物完全水解生成聚丙烯醇和醋酸钠,反应方程式为 ;
;
丙炔和乙酸在醋酸锌、200℃条件下发生加成反应生成CH2CHCHOOCCH3,反应方程式为 ,
,
故答案为:CH3COOCH=CHCH3; ;
; .
.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意III中水解生成的醇羟基连接碳碳双键不稳定,易转化为醛基,为易错点.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| 实验操作 | 实验现象 | 解释或结论 | |
| A | 加热(170℃)乙醇与浓硫酸混合物,将产生的气体直接通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫红色逐渐变浅 | 可能产生了SO2气体 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分为两层,下层是紫红色 | KI和氯水及苯发生反应 |
| C | 将少量SO2通入苯酚钠溶液中,振荡 | 溶液中出现浑浊 | 因为发生了反应: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把浓氨水加入到盛有Cu2O的试管中 | 溶液先无色,静置一段时间后变成蓝色 | Cu+被空气氧化成了Cu2+、使溶液显蓝色 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔 | |
| C. | 总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. |  化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 |
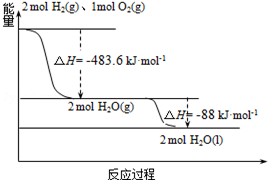 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
| A. | 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 |
| A. | Be原子的结构示意图: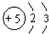 | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 质子数为53、中子数为78的碘原子可表示为:53131I | |
| D. | 乙烯的结构式:CH2=CH2 |
| A. | 0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合(pH=7): c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7): c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合: c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合: c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-) |
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 过氧化钠只有氧化性,用过氧化钠为潜水艇舱提供氧气 | |
| D. | FeCl3具有氧化性,用FeCl3溶液刻蚀印刷电路板 |