题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
CH3OH(g)+ H2O(g) H1=Q kJ·mol-1
ii. CO2(g)+ H2(g) ![]() CO(g)+H2O(g) H2=+41 kJ·mol-1
CO(g)+H2O(g) H2=+41 kJ·mol-1
iii. CO(g)+2H2(g) ![]() CH3OH(g) H3= 99 kJ·mol-1
CH3OH(g) H3= 99 kJ·mol-1
回答下列问题:
(1)Q=_________
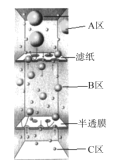
(2)图中能正确反映平衡常数K3(反应iii的平衡常数)随温度变化关系的曲线为__(填字母)
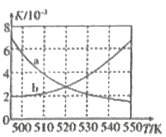
(3)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。490K时,根据曲线a、c判断合成甲醇时主要发生的反应为________(填“i”或“iii”);由曲线a可知,甲醇的量先增大后减小,其原因是_________________________________。
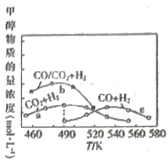
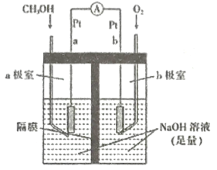
(4)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为____________,若隔膜为阳离子交换膜,则每转移6mol电子,溶液中有_______mol Na+向____________(填“正极区”或“负极区")移动。
(5)CO2经催化加氢也可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II :2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
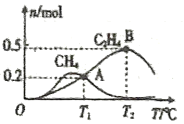
在1L恒容密闭容器中充入2molCO2和4molH2测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为______。T1℃时,反应I的平衡常数K=_________(保留三位有效数字)。
【答案】58 a i 温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少 CH3OH 6e- + 8OH- = CO32 +6H2O 6 正极区 30% 0.0129 L2mol 2
【解析】
⑴根据盖斯定律第二个方程式加第三个方程式得到第一个方程式。
⑵反应iii是放热反应,升高温度,平衡逆向移动,平衡常数减小。
⑶ 490K时,根据图像主要是发生曲线a反应;甲醇的量先增大后减小,其原因是温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少。
⑷甲醇燃料电池中燃料作负极,氧化剂作正极,每转移6mol电子,b极时有6mol OH-生成,根据原电池“同性相吸”原理。
⑸T1℃时,计算生成CH4、C2H4物质的量,根据方程式计算生成CH4、C2H4消耗CO2的物质的量,再计算总消耗CO2的物质的量,再计算CO2的转化率;T1℃时,先计算反应I生成CH4、H2O的物质的量,再计算消耗的CO2和H2的物质的量,再计算反应II生成C2H4、H2O的物质的量,再计算消耗的CO2、H2的物质的量,平衡时还剩余CO2、H2的物质的量,共生成H2O的物质的量,再求反应I的平衡常数。
⑴根据盖斯定律第二个方程式加第三个方程式得到第一个方程式,即H1 =+41 kJ·mol1+ ( 99 kJ·mol1) =58 kJ·mol1;故答案为:58。
⑵反应iii是放热反应,升高温度,平衡逆向移动,平衡常数减小,因此图中能正确反映平衡常数K3(的平衡常数)随温度变化关系的曲线为a;故答案为:a。
⑶ 490K时,根据图像主要是发生曲线a反应,因此合成甲醇时主要发生的反应为i;由曲线a可知,甲醇的量先增大后减小,其原因是温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少;故答案为:i;温度低于490K时单位时间内反应未达到平衡,温度升高速率加快,甲醇物质的量增多,温度高于490K时单位时间内反应达到平衡,反应i为放热反应,升高温度平衡左移,甲醇物质的量减少。
⑷甲醇燃料电池中燃料作负极,氧化剂作正极,因此电极a的反应为CH3OH失去电子,在氢氧化钠作用下生成碳酸根,其反应式为CH3OH 6e- + 8OH- = CO32 +6H2O,若隔膜为阳离子交换膜,则每转移6mol电子,b极时有6mol OH-生成,根据原电池“同性相吸”原理,因此溶液中有6 mol Na+向正极区移动;故答案为:CH3OH 6e- + 8OH- = CO32 +6H2O;6;正极区。
⑸T1℃时,生成CH4物质的量为0.2mol,生成C2H4物质的量为0.2mol,根据方程式生成0.2mol CH4,则消耗CO2物质的量为0.2mol,生成0.2mol C2H4,则消耗CO2物质的量为0.4mol,共消耗CO2物质的量为0.6mol,因此CO2的转化率为![]() ;T1℃时,反应I生成0.2mol CH4,0.4mol H2O,消耗0.2mol CO2,0.8mol H2,反应II生成0.2mol C2H4,0.8mol H2O,消耗0.4mol CO2,1.2mol H2,平衡时还剩余1.4mol CO2,2mol H2,共生成1.2mol H2O,因此反应I的平衡常数
;T1℃时,反应I生成0.2mol CH4,0.4mol H2O,消耗0.2mol CO2,0.8mol H2,反应II生成0.2mol C2H4,0.8mol H2O,消耗0.4mol CO2,1.2mol H2,平衡时还剩余1.4mol CO2,2mol H2,共生成1.2mol H2O,因此反应I的平衡常数 ;故答案为:30%;0.0129 L2mol 2。
;故答案为:30%;0.0129 L2mol 2。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案