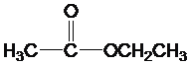
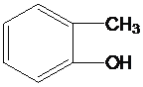
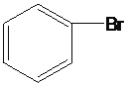
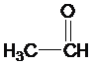
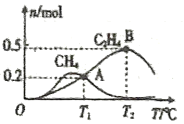
��Ŀ����
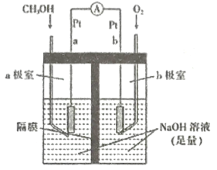
����Ŀ��ijʵ��С��̽��SO2��Cu(OH)2����Һ�ķ�Ӧ��
��1��ʵ��һ������ͼװ�ã��г�װ�����ԣ��������Ѽ��飩�Ʊ�SO2����SO2ͨ��Cu(OH)2����Һ�ķ�Ӧ�С�B�г���������ɫ�������Ժ�B��������Һ����ɫ����CuSO4��Һ��CuCl2��Һ����ɫ�����Բ�ͬ��
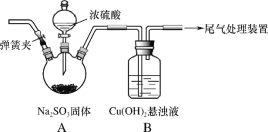
���ų�װ���еĿ�������������Է�Ӧ���ŵIJ�����_____���رյ��ɼС�
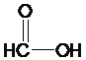
�ڴ�Һ©��������A�з�����Ӧ�ķ���ʽ��_____��
��2��ʵ�����Ϊȷ����ɫ����ɷ֣���������ʵ�飺
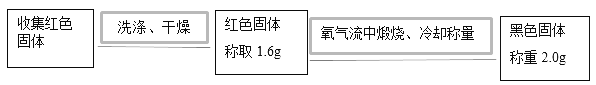
���������������պ�ɫ�����Ŀ����_____��
�ڸ�������ʵ��ɵý��ۣ��ú�ɫ����Ϊ_____��
��3��ʵ������Ϊ̽��B����Һ����ɫ��������ɫ��ԭ��ʵ�����£�
i.��4mL1mol/L��CuSO4��Һ��ͨ�����SO2��δ����Һ��ɫ�����仯��
ii.ȡ����B����Һ����������ϡ���ᣬ������ɫ�̼�����ζ�����壬�õ��������ɫ��Һ���ټ���BaCl2��Һ�����ְ�ɫ������
�������ϣ�SO2�����������»�ԭ�Խϲ
��ʵ��i��Ŀ��_____��
�ڸ�������ʵ��ɵý��ۣ���Һ����ɫ��ԭ������Һ�к��н϶�Cu(HSO3)2��С��ͬѧͨ����һ��ʵ��ȷ�������ֿ����ԣ�������1mol/L��CuSO4��Һ�м���_____��Һ���õ���ɫ��Һ��
��4������ʵ����Եó������ֺ�ɫ������ԭ���ǣ�_____���������ӷ���ʽ��ʾ����Һ������ɫ��ԭ���ǣ�_____�����û�ѧ����ʽ��ʾ��
���𰸡����ɼУ�ͨ��N2һ��ʱ�� H2SO4+Na2SO3=Na2SO4+SO2��+H2O ����ɫ����ת��Ϊ����ͭ Cu �ų��ܽ��SO2��H2SO3������Һ����ɫ�Ŀ����� NaHSO3��KHSO3 SO2+Cu(OH)2+2OH-=Cu+SO42-+2H2O 2SO2+Cu(OH)2=Cu(HSO3)2
��������
(1)��Ϊ�ų�������ʵ��ĸ��ţ��μ�Ũ����֮ǰӦ��ͨ�뵪�����������ų���
��װ��A�еķ�Ӧ���Ʊ�SO2�ķ�Ӧ��
(2)��SO2ͨ��Cu(OH)2����Һ�ķ�Ӧ�У�B�г���������ɫ�������п�����Cu��Cu2O����ߵĻ���
���������������պ�ɫ�����Ŀ���ǽ���ɫ����ת��Ϊ����ͭ�������ں��������жϣ�
����ʵ�������ʵ����������ɫ�����ƽ��Ħ��������������������ɷ֣�
(3)�ٸ���B��������Һ�п��ܵijɷֵȣ�ʵ��i�����ų����ֳɷ�����ɫ�Ŀ����ԣ�
��ȷ��Cu(HSO3)2ʹ��Һ����ɫ����Ҫ����Һ�м��뺬��HSO3-���ӵ����ʣ�
(4)���ֺ�ɫ������ԭ����������Cu����Һ������ɫ��ԭ�������˺�HSO3-���ӵ����ʡ�
(1)��Ϊ�ų�������ʵ��ĸ��ţ��μ�Ũ����֮ǰӦ��ͨ�뵪�����������ų�������Ϊ�����ɼУ�ͨ��N2һ��ʱ�䣬�رյ��ɼУ�
��װ��A�еķ�Ӧ���Ʊ�SO2�ķ�Ӧ����ѧ����ʽΪH2SO4+Na2SO3=Na2SO4+SO2��+H2O��
(2)��SO2ͨ��Cu(OH)2����Һ�ķ�Ӧ�У�B�г���������ɫ�������п�����Cu��Cu2O����ߵĻ���
���������������պ�ɫ�����Ŀ���ǽ���ɫ����ת��Ϊ����ͭ�������ں��������жϣ�
����ʵ���֪n(CuO)=![]() =0.025mol�����ɫ�����ƽ��Ħ������Ϊ
=0.025mol�����ɫ�����ƽ��Ħ������Ϊ![]() =64g/mol���ʺ�ɫ����Ϊͭ��
=64g/mol���ʺ�ɫ����Ϊͭ��
(3)��B��������Һ�п��ܺ����ܽ��SO2��H2SO3��Cu(HSO3)2��CuSO4�ȣ�CuSO4����Һ�г���ɫ����B ������Һ����ɫ��ʵ��i�����ų��ܽ��SO2��H2SO3������Һ����ɫ�Ŀ����ԣ�
��ȷ��Cu(HSO3)2ʹ��Һ����ɫ����Ҫ����Һ�м��뺬��HSO3-���ӵ����ʣ��ʿɼ���NaHSO3��KHSO3��
(4)���ֺ�ɫ������ԭ����������Cu�����ӷ���ʽΪ��SO2+Cu(OH)2+2OH-=Cu+SO42-+2H2O����Һ������ɫ��ԭ�������˺�HSO3-���ӵ����ʣ����ӷ���ʽΪ2SO2+Cu(OH)2=Cu(HSO3)2.

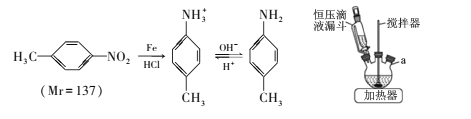
 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�����Ŀ��������ͪ�㷺Ӧ����ҩ��ϳɣ�ͬʱҲ���л����ϡ�ɱ����ȵ���Ҫ�м��塣ʵ�����Ա��뱽������Ϊԭ�ϣ���AlCl3�������Ʊ�������ͪ��ʵ����������ͼ��ʾ��
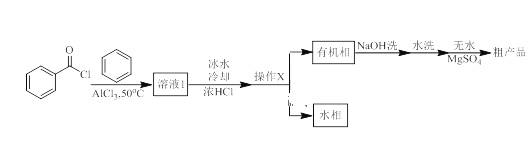
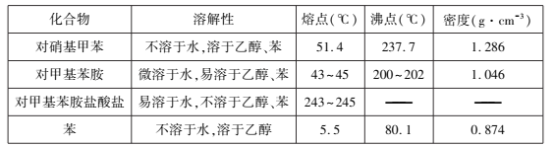
������������������������±���
���� | ��Է� ������ | �ܶ�/g��cm-3 | �۵�/oC | �е�/oC | �ܽ��� |
�� | 78 | 0.88 | 5.5 | 80.1 | ����ˮ�������Ҵ� |
�������� | 140.5 | 1.22 | 1 | 197 | ��ˮ�ֽ� |
��ˮ�Ȼ��� | 133.5 | 2.44 | 190 | 178�������� | ��ˮˮ�⣬�ܱ� |
������ͪ | 182 | 1.11 | 48.5 | 305����ѹ�� | ����ˮ�����ܱ� |
��֪����Ӧԭ��Ϊ�� ���÷�Ӧ���ҷ��ȡ�
���÷�Ӧ���ҷ��ȡ�
�ش��������⣺
��1����Ӧװ����ͼ��ʾ�����Ⱥͼг�װ������ȥ����Ѹ�ٳ�ȡ7.5 g��ˮ���Ȼ�����������ƿ�У��ټ���30 mL��ˮ�������裬�����μ�6 mL��������ı������ȡ���ӦҺ����ɫ��Ϊ��ɫ�����Ȼ������ܽ⡣��������50�����ҷ�Ӧ1.5��2 h��
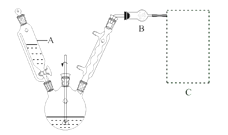
����A������Ϊ_______��װ��B������Ϊ_______�������μӱ������ȵ�ԭ����______������ΪC��װ�õ���_______�����ţ���
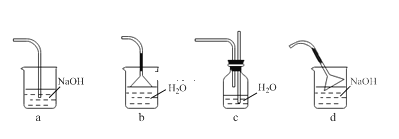
��2������XΪ___________��
��3��NaOH��Һϴ�ӵ�Ŀ����_____________��
��4���ֲ�Ʒ�Ⱦ���ѹ�����ȥ__________���ټ�ѹ����õ���Ʒ��
��5���������Ʒ�۵�Ϊ________ʱ��ȷ����ƷΪ��Ʒ����֪ʵ���������ô�Ʒ8.0 g����ʵ�����Ϊ_________ %��������λ��Ч���֣���