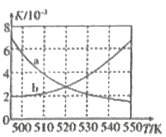
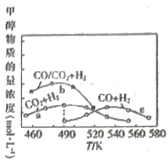
题目内容
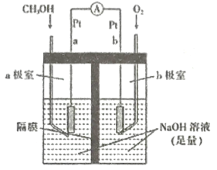
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
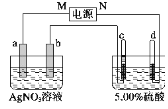
(1)直流电源中,M为_________极。
(2)Pt电极上生成的物质是_________,其质量为___________g。
(3)AgNO3溶液的浓度______填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH_________,硫酸的浓度________, 硫酸的pH_________。
【答案】正 Ag 2.16 不变 不变 增大 减小
【解析】
(1)电解5.00%的稀硫酸,实际上是电解其中的水,阴极H+得到电子产生H2,阳极OH-失去电子产生O2,且V(H2):V(O2)=2:1,根据装置图中电极气体体积分析,可确定d极为阴极,则电源的N极为负极,c极为阳极,b为阴极,a为阳极,M为正极,故答案为:正;
(2)根据硫酸溶液电解水的反应,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol,说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生Ag:0.02mol×108g/mol=2.16g,故答案为:Ag;2.16;
(3)由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,阳极溶解Ag的质量等于阴极析出Ag质量,相当于电解质溶液中AgNO3没有参加反应,因此AgNO3的浓度不变,pH也不便,电解5.00%的硫酸溶液,因为是其中的水发生电解,因此H2SO4溶液浓度增大,pH减小,故答案为:不变;不变;增大;减小。

 口算题天天练系列答案
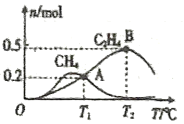
口算题天天练系列答案【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行