题目内容
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
【答案】D C Li+核电荷数较大
【解析】
(1)原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高;
(2)电子层结构相同的离子,离子核电荷数越大,其吸引电子能力越大。
(1) 基态多电子原子的核外电子排布应该遵循能量最低原理,即一般按照能级顺序填充(1s<2s<2p)。因此能量最低的状态就是先排满1s,再排2s,即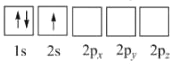 ,能量最低的(基态)原子为D;2个电子排在2px上,1个电子排布在2s上,是四个选项中能量最高的状态,能量最高的原子是C。故填D;C;
,能量最低的(基态)原子为D;2个电子排在2px上,1个电子排布在2s上,是四个选项中能量最高的状态,能量最高的原子是C。故填D;C;
(2) Li+与H-具有相同的电子构型,Li+核电荷数为3,H-核电荷数为1,电子结构相同时,核电荷数越大,原子核对核外电子的吸引能力越大,离子半径就越小。故答案为:Li+核电荷数较大。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】二苯甲酮广泛应用于药物合成,同时也是有机颜料、杀虫剂等的重要中间体。实验室以苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮的实验流程如下图所示:
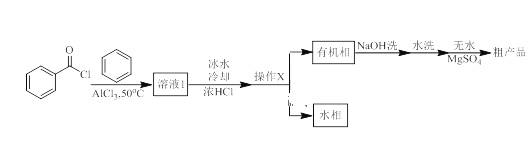
相关物理常数和物理性质如下表:
名称 | 相对分 子质量 | 密度/g·cm-3 | 熔点/oC | 沸点/oC | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
苯甲酰氯 | 140.5 | 1.22 | 1 | 197 | 遇水分解 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
二苯甲酮 | 182 | 1.11 | 48.5 | 305(常压) | 难溶水,易溶苯 |
已知:反应原理为: 。该反应剧烈放热。
。该反应剧烈放热。
回答下列问题:
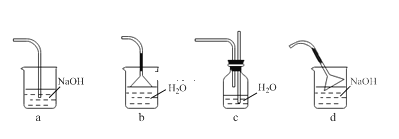
(1)反应装置如图所示(加热和夹持装置已略去),迅速称取7.5 g无水三氯化铝放入三颈瓶中,再加入30 mL无水苯,搅拌,缓慢滴加6 mL新蒸馏过的苯甲酰氯。反应液由无色变为黄色,三氯化铝逐渐溶解。混合完后,保持50℃左右反应1.5~2 h。
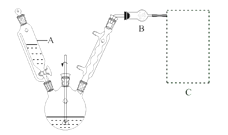
仪器A的名称为_______。装置B的作用为_______。缓慢滴加苯甲酰氯的原因是______。能作为C中装置的是_______(填标号)。
(2)操作X为___________。
(3)NaOH溶液洗涤的目的是_____________。
(4)粗产品先经常压蒸馏除去__________,再减压蒸馏得到产品。
(5)当所测产品熔点为________时可确定产品为纯品。已知实验最终所得纯品8.0 g,则实验产率为_________ %(保留三位有效数字)。