题目内容
室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为
①1.0×10-7mol/L ②1.0×10-6mol/L ③1.0×10-2mol/L ④1.0×10-12mol/L
| A.①④ | B.③② | C.④ | D.③④ |
D
解析试题分析:
 =
= ,
, =
=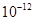 ,
,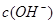 =
=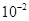 ,当溶质为强碱时,溶液中的
,当溶质为强碱时,溶液中的 完全由水电离出来,此时水电离的c(OH-)=
完全由水电离出来,此时水电离的c(OH-)=  =
=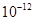 ,当溶质为强碱弱酸盐时,弱酸根离子发生水解,溶液中的
,当溶质为强碱弱酸盐时,弱酸根离子发生水解,溶液中的 离子完全由水电离出来,此时c(OH-)=
离子完全由水电离出来,此时c(OH-)= 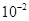 ,所以D正确。
,所以D正确。
考点:考查电离。

练习册系列答案
相关题目
下列有关说法正确的是 ( )
| A.25℃时,0.1mol·L-1的三种溶液的pH关系为:pH(NaHCO3) > pH(Na2CO3) >pH(CH3COONa) |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 |
| C.25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大。 |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
下列粒子能促进水的电离,且使溶液呈酸性是
| A.CO32- | B.Fe3+ | C.HSO4- | D.Cl- |
下列有关说法正确的是
| A.将Al2(SO4)3溶液蒸干得到Al2(SO4)3固体 |
| B.用广泛pH试纸测得某溶液pH为11.3 |
| C.向纯水通入少量HCl气体,水的电离程度减小,Kw减小 |
| D.向0.1 mol·L-1 CH3COOH溶液中加少量水,溶液中所有离子的浓度都减小 |
相同温度下,物质的量浓度相同的四种溶液:①CH3COONa ;②NaHSO3;③NaCl;④Na2SiO3,按pH由大到小的顺序排列正确的是
| A.④①③② | B.①④③② | C.①②③④ | D.④③①② |
为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是
| A.配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C.对盐酸和醋酸溶液进行导电性实验,若与CH3COOH溶液相串联的灯泡较暗,证明醋酸为弱电解质 |
| D.配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
有①Na2CO3溶液;②CH3C00Na溶液;③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,
下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1 mol/L盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |