题目内容
对H2O的电离平衡不产生影响的粒子是( )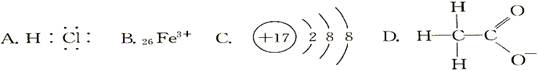
C
解析试题分析:根据影响水电离的因素来进行判断,影响水的电离的因素有温度、酸、碱、盐等,加热促进电离;加酸、加碱抑制水的电离;加能水解的盐促进水的电离;A、电子式表示HCl,酸抑制水的电离,错误;B、离子符号表示三价铁离子,水溶液中能水解,促进水的电离,错误;C、离子结构示意图表示氯离子,对水的电离无影响,正确;D、结构式表示醋酸根离子,水溶液中能水解,促进水的电离,错误。
考点:考查水的电离的影响因素及化学用语。

练习册系列答案
相关题目
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH = 4的盐酸稀释后,溶液中所有离子的浓度均降低 |
25℃时,下列叙述中,正确的是( )
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |
现有等体积的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( )
| A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则KOH溶液pH最大 |
| B.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 |
| C.若混合前三种溶液物质的量浓度相等,混合后恰好完全中和,则V1>V2>V3 |
| D.若混合前三种溶液pH相等,混合后恰好完全中和,则V1>V2>V3 |
25℃时,下列说法不正确的是( )
| A.NaHCO3溶液和Na2CO3溶液中含有的粒子种类完全相同 |
| B.用一定浓度的NaOH溶液滴定氢氟酸,当pH=6时,溶液中c(F-)-c(Na+)=9.9×10-7mol/L |
| C.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| D.用0.2 mol/L NaOH溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为
①1.0×10-7mol/L ②1.0×10-6mol/L ③1.0×10-2mol/L ④1.0×10-12mol/L
| A.①④ | B.③② | C.④ | D.③④ |
常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH 和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
| A.1 mol/L 60mL | B.0.5 mol/L80mL |
| C.0.5 mol/L40mL | D.1 mol/L80mL |