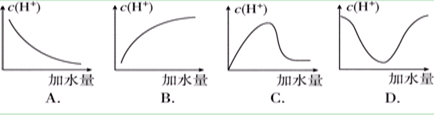
题目内容
常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,下列叙述正确的是( )
①该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1<V2
③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)=c(A-)+c(HA)
④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中 2c(H+)+c(HA)=c(A-)+2c(OH-)
A .① B .②③ C.②④ D.③④
C
解析试题分析:①常温下,0.1mol·L-1某一元酸(HA)溶液pH = 3,则该酸是弱酸。C(H+)=10-3, C(H+)(水)=C(OH-)=10-14/10-3=10-11.HA是弱酸,部分电离;HCl是强酸。完全电离。②用pH=3的HA溶液与pH=4的HCl溶液分别中和等浓度等体积的氢氧化钠溶液所耗去酸液的体积分别为V1和V2,其关系为10V1小于V2。③pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液含有生成的盐及未电离的酸分子。C(H+) +c(Na+)=c(A-)+c(HA)。错误。④0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液为NaA和HA等浓度的混合液。 物料守恒得C(HA)+C(A-)=2C(Na+)电荷守恒得:C(A-)+C(OH-)=C(H+)+C(Na+),然后综合一下就可以得出这个等式。选项为:C。
考点:考查弱电解质的电离及溶液中各种离子浓度大小的比较的知识。

对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是( )
| A.分别升高温度,两种溶液的pH均减小 |
| B.相同温度下两种溶液的pH:Na2CO3> NaHCO3 |
| C.分别加入少量NaOH,两溶液中c(CO32-)均增大 |
| D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-) |
将 a g 含NaOH样品溶解在 b mL 0.l mol·L-1的硫酸中,再加入 c mL 0.1 mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是( )
| A.[(b-c)/125a]×100% | B.[(b-2c)/125a]×100% |
| C.[(b-c)/250a]×100% | D.[(8b-8c)/a]×100% |
25℃时,下列叙述中,正确的是( )
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |
现有等体积的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( )
| A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则KOH溶液pH最大 |
| B.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 |
| C.若混合前三种溶液物质的量浓度相等,混合后恰好完全中和,则V1>V2>V3 |
| D.若混合前三种溶液pH相等,混合后恰好完全中和,则V1>V2>V3 |
室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为
①1.0×10-7mol/L ②1.0×10-6mol/L ③1.0×10-2mol/L ④1.0×10-12mol/L
| A.①④ | B.③② | C.④ | D.③④ |
在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为
| A.2.4×10-7mol/L | B.0.1×10-7mol/L |
C.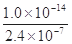 mol/L mol/L | D.无法确定 |