题目内容
有①Na2CO3溶液;②CH3C00Na溶液;③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,
下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL 0.1 mol/L盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
C
解析试题分析:A错误,③最大,因为氢氧化钠是强碱,完全电离。前两者都是弱电解质,酸根离子对应的酸的酸性越弱,相应的该酸根离子水解程度越大,所以相同浓度的碳酸钠水解程度比醋酸钠大,即pH①>②。顺序应该是③>①>②。B错误,变化最大的应该是氢氧化钠,因为加水稀释会促进水解,则弱盐溶液的pH变化就小。C正确,加入25mL 0.1 mol/L盐酸后,氢氧化钠溶液最终变为氯化钠溶液,室温时pH是7。醋酸钠溶液最终变为醋酸与氯化钠的混合溶液,室温时pH小于7.碳酸钠溶液最终变为碳酸氢钠溶液,室温时pH大于7。综上,pH最大的是①。D错误,pH相同的情况下,浓度的大小应该是A中顺序的倒序,即②<①<③。
考点:盐水解的影响因素

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为
①1.0×10-7mol/L ②1.0×10-6mol/L ③1.0×10-2mol/L ④1.0×10-12mol/L
| A.①④ | B.③② | C.④ | D.③④ |
在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为
| A.2.4×10-7mol/L | B.0.1×10-7mol/L |
C.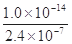 mol/L mol/L | D.无法确定 |
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH 和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
| A.1 mol/L 60mL | B.0.5 mol/L80mL |
| C.0.5 mol/L40mL | D.1 mol/L80mL |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
25℃时,将稀氨水逐滴滴加到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
| A.c(NH4+)=c(SO42-) |
| B.c(NH4+)>c(SO42-) |
| C.c(NH4+)<c(SO42-) |
| D.c(NH4+)+c(SO42-)=c(H+)=c(NH4+) |
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是
A. ×100% ×100% | B.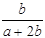 ×100% ×100% |
C.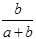 ×100% ×100% | D. ×100% ×100% |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
下列叙述正确的是( )
| A.在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变 |
| B.Na2CO3溶液加水稀释后再恢复至原温度, pH和KW均减小 |
| C.室温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)之比104:1 |
| D.25℃,若测知氨水与NH4Cl混合溶液的pH>7,则溶液中c(NH4+)>c(Cl—) |