题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中的c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中的c(NH4+)。
(3)浓度均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示:

①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________,导致pH随温度变化的原因是________________________________________________;
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示:
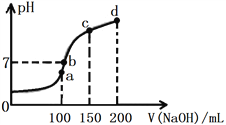
试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________________。
(5)难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(Al3+)=0.1molL﹣1,使Al3+开始沉淀的pH为________。(25℃时,Al(OH)3的Ksp=1×10-34)
【答案】 Al3+ + 3H2O ![]() Al(OH)3(胶体) + 3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降,从而达到净水目的 小于 I NH4Al(SO4)2水解使溶液呈酸性,升高温度使NH4+、Al3+水解程度增大,pH减小 10-3 mol·L-1 或(10-3 - 10-11)mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) 3
Al(OH)3(胶体) + 3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降,从而达到净水目的 小于 I NH4Al(SO4)2水解使溶液呈酸性,升高温度使NH4+、Al3+水解程度增大,pH减小 10-3 mol·L-1 或(10-3 - 10-11)mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) 3
【解析】(1) Al3+ 为弱碱的阳离子,水解生成Al(OH)3胶体,Al3+ + 3H2O ![]() Al(OH)3(胶体) + 3H+,胶体具有较强的吸附能力,可除去颗粒状杂质,使水达到净化的目的;
Al(OH)3(胶体) + 3H+,胶体具有较强的吸附能力,可除去颗粒状杂质,使水达到净化的目的;
(2) 在NH4Al(SO4)2溶液中,NH4+和Al3+ 都是弱碱的阳离子,水解呈酸性,所以Al3+ 的水解对NH4+的水解起抑制作用,但抑制程度不大,而在NH4HSO4溶液中,完全电离出来的H+浓度很大,对NH4+的水解抑制程度很大,所以前者的c(NH4+)小于后者的c(NH4+);
(3) ① NH4Al(SO4)2在溶液中因水解使溶液呈酸性,即pH<7, 又水解是吸热反应,随着温度的升高,水解程度增大,生成的c(H+)增大,pH减小,因此曲线I是正确的;② 20 ℃ 时,NH4Al(SO4)2溶液的pH=3, 即c(H+)=1.0×10-3 mol·L-1,溶液中存在的电荷守恒为2c(SO42-) +c(OH-)=c(NH4+) +3c(Al3+)+ c(H+),则2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)- c(OH-)= 1.0×10-3 mol·L-1—1.0×10-11 mol·L-1=1.0×10-3 mol·L-1;
(4) NH4HSO4完全电离产生的H+抑制水的电离,使水的电离程度减小,NH4+的水解促进水的电离,使水的电离程度增大,但水解程度很小,所以H+抑制水的电离是主要的,此时水的电离程度很小,随着NaOH的加入,当H+被完全中和后,NH4+的水解促进水的电离起主要作用,溶液呈弱酸性,水的电离程度最大,即图象中的a点水的电离程度最大;在b点pH=7,即c(H+)=c(OH-)1.0×10-7 mol·L-1,溶液呈中性,此时溶液中发生的反应为2NH4HSO4 +2NaOH= (NH4)2SO4+Na2SO4+ H2O和极少量的(NH4)2SO4+2NaOH= Na2SO4+ NH3·H2O,因此溶液中c(Na2SO4)> c[(NH4)2SO4],则有c(Na+)>c(SO42-)> c(NH4+) >c(OH-) =c(H+)。
(5)已知25℃ Al(OH)3的Ksp=1×10-34,当c(Al3+)=0.1 molL﹣1时,要使Al3+开始沉淀则c(OH-)=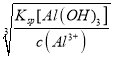 =
=![]() =1×10-11 molL﹣1,求得pH=3。
=1×10-11 molL﹣1,求得pH=3。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。