题目内容
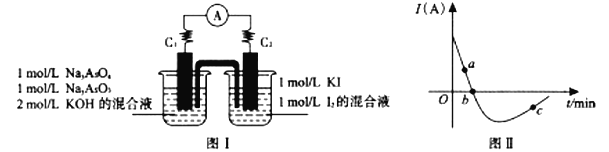
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
【答案】 2Fe3++Cu=2Fe2++Cu2+ 0.1 4mL0.2mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 2Cu2++4SCN-=2CuSCN↓+(SCN)2 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 慢 取少量反应I的溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是一个不可逆反应 Fe2+被硝酸氧化为Fe3+,溶液中Fe2+浓度降低,导致干衡Fe2++NO![]() Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由综色变为黄色
Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由综色变为黄色
【解析】(1)Fe3+与Cu粉发生反应生成亚铁盐和铜盐,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+;(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:步骤1:取4mL 0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,步骤2:取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2,故答案为:0.1;取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液;2Cu2++4SCN-=2CuSCN↓+(SCN)2;(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ的慢;②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应,故答案为:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
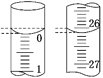
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。