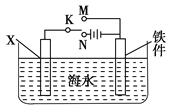
��Ŀ����
����Ŀ����.������أ�K2FeO4����һ�����͡���Ч�������ɫ����ˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ�������ص���Ҫ��ӦΪ��2FeSO4�� 6Na2O2=2Na2FeO4��2Na2O��2Na2SO4��O2�����÷�Ӧ�й������ƣ�Na2O2������Ԫ�ػ��ϼ�Ϊ______������������________________���ѧʽ����
��2��ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO����OH����FeO42����Cl����H2O��
�ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____________________________________________��
��ÿ����1 mol FeO42��ת��________mol���ӣ�����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ________mol��
��.��֪��2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-��
(1)����1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������________��
(2)����a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I-��Fe2+��Br-��ȫ������ʱ��cΪ__________________���ú�a��b�Ĵ���ʽ��ʾ����
���𰸡�-1 Na2FeO4��O2 2Fe(OH)3+3ClO��+4OH��=2FeO42��+3Cl��+5H2O 3 0.15 I-��Fe2+ ��3a+3b��/2
��������
���ݻ��ϼ۱仯�ж��������ͻ�ԭ��������ת�Ƶ����غ�����������ͻ�ԭ�������ʵ�����ϵ��
��.(1)���������д��ڵ��ǹ���������Ԫ�ػ��ϼ�Ϊ��1�����������ǻ��ϼ�����֮��õ��IJ�����Ը÷�Ӧ��������Ϊ��Na2FeO4��O2��
(2) ���������ͻ�ԭ�������ʵ����ı�Ϊ3:2�����������ϼ۽�����Ԫ�صĻ��ϼ۱仯Ϊ2�ۣ���Ԫ�ػ��ϼ۱仯Ϊ3�ۣ����ݵ���ת���غ��жϣ�2Fe(OH)3Ϊ��ԭ����3ClO��Ϊ�����������ӷ���ʽΪ��2Fe(OH)3+3ClO��+4OH��=2FeO42��+3Cl��+5H2O��
����Ԫ�ذ����ϼ���+3������Ϊ+6�ۣ�����ÿ����1 mol FeO42��ת��3mol���ӣ���Ԫ�ػ��ϼ���+1����Ϊ-1����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ0.3mol/2=0.15mol���ʴ�Ϊ��3 ��0.15��
��. (1) ��������ԭ��Ӧ�л�ԭ���Ļ�ԭ��ǿ�ڻ�ԭ����ģ����Ի�ԭ��ǿ��˳����I����Fe2����Br���������������������ĵ���I����Ȼ����Fe2���������Br�������ݵ��ӵĵ�ʧ�غ��֪��2mol����������2molI����2molFe2�������Դ�ʱ��������������I-��Fe2+��
(2) ���ݵ��ӵĵ�ʧ�غ��֪��2c��2a����a��b����2b����c��![]() ��
��