题目内容
【题目】下列叙述正确的是( )
A. 石油、沼气、天然气、植物油都属于可再生能源
B. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
C. 水蒸气变为液态水时放出的能量就是该变化的反应热
D. 同温同压下,H2(g)+Cl2(g) ![]() 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
【答案】B
【解析】试题分析:A.沼气、植物油都属于可再生能源,石油、天然气都是不可再生的能源,错误;B.由于物质发生反应的能量变化只与物质的开始的状态及终止状态有关,而与途径无关,所以应用盖斯定律,可计算某些难以直接测量的反应焓变,也可以计算不容易测定的反应的反应热,正确;C.水蒸气变为液态水时放出的能量就是该变化的能量差,不是反应热,错误;D.反应热与反应条件无关,只与反应物、生成物的状态及多少有关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同,错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_________。
(2)已知:反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
①在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在低温时选择反应_____(填“I”或“II”)。
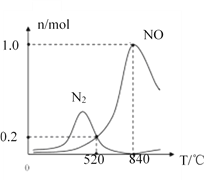
③520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
A.降低反应温度 B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比 D. 充入一定量的氦气
(3)己知25℃时HCN和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7×10-11 |
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为______,向NaCN溶液中通入少量CO2,则发生反应的化学方程式为:______________________。