题目内容
18.一个真空密闭容器中盛有2amolPCl5,加热到200℃时发生如下反应:PCl5(气)?PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%.若在同一温度和同一容器中,最初投入是amolPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系( )| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
分析 在一定体积的容器中,开始加入amolPCl5所到达的平衡,等效于为先将体积增大1倍投入2amolPCl5,到达的平衡状态,而体积不变,增大压强压缩体积,据此判断.
解答 解:在一定体积的容器中,开始加入amolPCl5所到达的平衡,等效于为先将体积增大1倍投入2amolPCl5,到达的平衡状态,而体积不变,增大压强压缩体积,增大压强平衡向体积减小的方向移动,即平衡向逆反应方向移动,PCl5所占体积分数增大,故M>N,故选A.
点评 考查等效平衡,难度中等,关键是设计平衡建立的途径,可以直接等效为增大压强.

练习册系列答案
相关题目
5.在同温同压下,两个容积相同的储气瓶,一个装满O2,另一个装满CH4,以下有关两瓶气体的计算不正确的是( )
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
6.在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 1L0.1mol•L-1(NH4)2Fe(SO4)2•6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)═c(OH-)+c (SO42-) | |
| B. | 0.1 mol•L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-) | |
| C. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| D. | 等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:c(OH-)+c(CO32-)═c(HCO3-)+c(H2CO3)+c(H+) |
13.下列各组内的物质不属于同系物的是( )
| A. | CH3-CH3 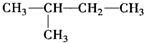 | |
| B. | CH2═CH-CH3 CH2═CH-CH2-CH3 | |
| C. | CH3-CH2-OH CH3-CH2-CH2-CH3 | |
| D. | 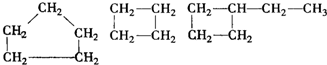 |
3. (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
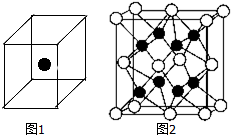
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
10.1g干冰中含氧原子a个,则阿伏加德罗常数的值是( )
| A. | 22a | B. | 28a | C. | 18a | D. | 17a |

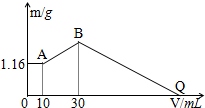 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答: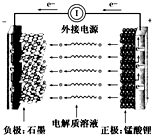 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题: