题目内容
16.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成.取上层清液,通入CO2,有白色沉淀产生,该白色沉淀的化学式为Al(OH)3.
(2)Z为两种气体的混合物,试剂a为适量水,写出其中发生氧化还原反应的方程式3NO2+H2O=2HNO3+NO.
(3取Y中的溶液通入过量氯气,并不断搅拌,充分反应后,溶液中所有的阳离子有(填写离子符号)Cu2+、Fe3+、Al3+、H+.
(4)另取原样品,加入足量稀硫酸充分反应.若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(用化学式表示)Al、CuO、C和Fe2O3或Al、CuO、C、Fe、Fe2O3.
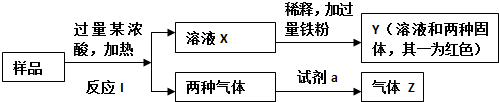
分析 能与Fe2O3、Fe、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与Fe、C、Al单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,Fe和Al被氧化为Fe3+和Al3+;如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同,无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐;
(1)通入二氧化碳后生成白色沉淀,则白色沉淀为氢氧化铝;
(2)Z为两种气体的混合物,则Z为NO和二氧化碳,混合气体为二氧化氮和二氧化碳;
(3)向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉;向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:Cl2+2Fe2+=2Cl-+2Fe3+、2Fe3++Cu=2Fe2++Cu2+、Cl2+H2O=HCl+HClO;根据(1)可知Y中含有偏铝酸根离子,则反应后生成铝离子,据此进行判断;
(4)由前几问知,样品中一定含有Al,一定有CuO和C,加入足量稀硫酸后一定不产生Cu,一定含有Fe2O3,否则会生成铜单质,据此进行判断.
解答 解:能与Fe2O3、Fe、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与Fe、C、Al单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,Fe和Al被氧化为Fe3+和Al3+;如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同,无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐,
(1)加入过量氢氧化钠后有沉淀生成,取上层清液,通入足量CO2,生成白色沉淀,说明样品中一定含有的物质是Al,上层清液与足量CO2反应生成沉淀的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,该白色沉淀为:Al(OH)3,
故答案为:Al(OH)3;
(2)二氧化氮可以和水反应生成一氧化氮气体,Z中两种气体是NO、CO2,发生氧化还原反应的方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉,这个过程发生了置换反应:Cu2++Fe=Cu+Fe2+,向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:Cl2+2Fe2+=2Cl-+2Fe3+,2Fe3++Cu=2Fe2++Cu2+,Cl2+H2O=HCl+HClO;根据(1)可知溶液中含有偏铝酸根离子,反应后生成铝离子;所以充分反应后,溶液中的阳离子是:Cu2+、Fe3+、Al3+、H+(特别注意没有了Fe2+),
故答案为:Cu2+、Fe3+、Al3+、H+;
(4)根据以上分析可知,原溶液中一定含有Al、CuO和C,加入足量稀硫酸充分反应.若溶液中一定不会产生Y中的红色固体,则一定含有Fe2O3,否则铝会转化成铜,所以原固体组成可能为:Al、CuO、C和Fe2O3或Al、CuO、C、Fe、Fe2O3,
故答案为:Al、CuO、C和Fe2O3或Al、CuO、C、Fe、Fe2O3.
点评 无机推断题为主体的综合题,主要考查金属单质、金属氧化物、非金属单质的性质,题目难度中等,试题综合性强,涉及知识面广,充分考查学生的分析、理解能力及逻辑推理能力.

| A. | 1L0.1mol•L-1(NH4)2Fe(SO4)2•6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)═c(OH-)+c (SO42-) | |
| B. | 0.1 mol•L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-) | |
| C. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| D. | 等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:c(OH-)+c(CO32-)═c(HCO3-)+c(H2CO3)+c(H+) |
| A. | 硫酸洗涤 | B. | 稀盐酸洗涤 | C. | 水洗涤 | D. | 醋酸洗涤 |

| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛有浓硫酸的洗气瓶 | |
| C. | 除去乙烷中混有水蒸气,通过碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
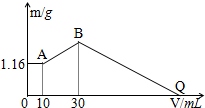 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:

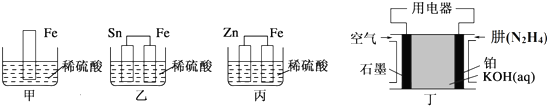
 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题: