题目内容
18.下列金属的冶炼,均不能用热还原法制得一组是( )| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
分析 金属冶炼的方法有:
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得;
解答 解:能用热还原法制得的金属性质较不活泼,如Zn、Fe、Sn、Pb、Cu等;
A.Na、Ca、Mg、Al、K都是活泼金属,用电解法制取,都不能用热还原反应制取,故A选;
B.Na、K用电解法制取,不能用热还原反应,Zn、Fe用热还原反应,Hg用热分解法,故B不选;
C.Zn、Fe、Cu、Sn能够用热还原法,Ag用热分解法制取,故C不选;
D.Mg、Al用电解法制取,不能用热还原法制取,Zn、Fe、Pb用热还原法制取,故D不选;
故选:A.
点评 本题考查金属冶炼的一般方法和原理,熟悉金属的活泼性与冶炼方法是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列除杂过程中,选用试剂和方法正确的是( )
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛有浓硫酸的洗气瓶 | |
| C. | 除去乙烷中混有水蒸气,通过碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
13.下列说法正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
10.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 每摩尔-CH3中含10NA个电子 | |
| B. | 每摩尔CnH2n+2中,碳原子与碳原子形成的共用电子对数目为nNA | |
| C. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| D. | 每摩尔苯中含有的碳氢单键的数目为6NA |
13.下列排列顺序正确的是( )
| A. | 原子半径:O>N>C | B. | 热稳定性:H2O>HF>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4>HClO4 |
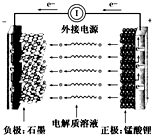 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题: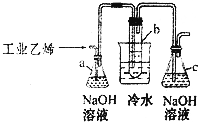 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br