题目内容
12.常温下,KSP[Mn(OH)2]=2.0×10-13.实验室制氯气的废液中含c(Mn2+)=0.1mol•L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于( )| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
分析 Mn2+沉淀较为完全时,c(Mn2+)≤1×10-5mol/L,根据Ksp求出OH-离子的浓度,再根据Kw求出氢离子的浓度,然后计算出pH,据此进行计算.
解答 解:Mn2+沉淀较为完全时的浓度≤1×10-5mol/L,已知Ksp=c(Mn2+)×c2(OH-),
则c(OH-)≥$\sqrt{\frac{{K}_{sp}}{c(M{n}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-13}}{1×1{0}^{-5}}}$mol/L=$\sqrt{2}$×10-4mol/L,
则c(H+)≤$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\sqrt{2}×1{0}^{-4}}$mol/L=$\frac{\sqrt{2}}{2}$×10-10mol/L,
所以pH≥-lg$\frac{\sqrt{2}}{2}$×10-10=10+$\frac{1}{2}$lg2,
故选C.
点评 本题考查溶度积常数及溶液pH的计算,题目难度中等,注意掌握难溶物溶度积常数的概念及计算方法,明确Mn2+沉淀较为完全时c(Mn2+)≤1×10-5mol/L为解答关键.

练习册系列答案
相关题目
3.某微粒用${\;}_{Z}^{A}{R}^{n+}$表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
20.下列化学用语正确的是( )
| A. | CH4分子的球棍模型: | B. | 硝基苯的结构简式: | ||
| C. | 苯的最简式 C6H6 | D. | 1-丁醇的键线式: |
7.下列有关检验与鉴别说法正确的是( )
| A. | 用新制氢氧化铜悬浊液能鉴别葡萄糖、甘油、乙醛、乙酸 | |
| B. | 用酸性高锰酸钾即可检验CH2=CHCHO中的碳碳双键 | |
| C. | 为检验氯乙烷中的氯元素,在水解液中滴加稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀 | |
| D. | 用溴水即可鉴别溴苯、苯、己烯与苯酚 |
17.Zn还原SiCl4的反应如下:下列说法正确的是( )
SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)?Si(s)+2ZnCl2(g)△H2.
SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)?Si(s)+2ZnCl2(g)△H2.
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加Zn(g)的量,△H2变大 | |
| D. | 以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生. |
4.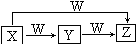 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )| A. | 若X为HNO3,则W可能为Fe | |
| B. | 若W为O2,X可能是S | |
| C. | 若W为O2,则Z可能为NO | |
| D. | X→Z的离子反应可能为Al3++4OH-=AlO2-+2H2O |
1. 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
(1)A原子的最外层电子排布式为3s23p4,D原子共有14种不同运动状态的电子,F的离子的价层电子轨道示意图为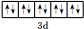 .
.
(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
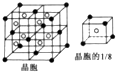
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为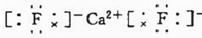 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
.(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为
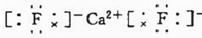 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
2.下列用离子方程式解释正确的是( )
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.