题目内容
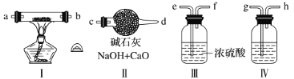
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难落于水的物质,能熔于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按 照气流由左到右的方向,上述装置合理的连接顺序为a →____ →____ →f→g→_____ →____→d→e→j。(填仪器接口字母)_____________
(2)装置A中导管m的作用是________________________________。
(3)装置D中除生成TiCl4 外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________________________________。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:________________________________。
(5)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_______________。
【答案】 c,b,h,i 平衡压强,使浓盐酸更易滴落 TiO2+ 2C+2Cl2![]() TiCl4+ 2CO 取少量收集到的液体于洁净试管中,滴加适量水,液体变浑浊,则收集到的液体中含有TiCl4 蒸馏
TiCl4+ 2CO 取少量收集到的液体于洁净试管中,滴加适量水,液体变浑浊,则收集到的液体中含有TiCl4 蒸馏
【解析】(1)由实验目的、装置图和题中信息可知,A为制取氯气装置;B为干燥氯气装置;D为制备TiCl4的反应容器;E为接收TiCl4装置;F为尾气处理装置,收集D中生成的CO气体;C可防止水蒸气进入E而使TiCl4水解,所以按照气流由左到右的方向,上述装置合理的连接顺序为a→c→b→f→g→h→i→d→e→j。
(2)装置A中导管m连接分液漏斗和圆底烧瓶,使二者内部压强相等,平衡了压强,使浓盐酸更易滴落。
(3)装置D中氯气、TiO2和碳粉反应,除生成TiCl4外,同时生成一种气态不成盐氧化物,根据原子守恒可得该气态不成盐氧化物为CO,该反应的化学方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO。
TiCl4+2CO。
(4)由已知TiCl4易水解生成难落于水的物质,故可用加水的方法证明装置E中收集到的液体中含有TiCl4,取少量收集到的液体于洁净试管中,滴加适量水,液体变浑浊,则收集到的液体中含有TiCl4。
(5)由已知,TiCl4能溶于有机溶剂,分离相互溶解的两种液体混合物,常用蒸馏的方法,故制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为:蒸馏。