题目内容
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
(1)装置Ⅳ中盛放的药品是________,其作用是_______________________________。
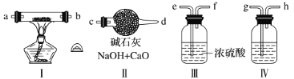
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)____________,各仪器接口的标号字母顺序是:空气进入________,________接________,________接________,________接________(用字母表示)。
(3)装置Ⅱ的作用_________________________________________。
(4)操作中通空气和加热的顺序为_______________________________。
【答案】 氢氧化钠溶液 吸收导入的空气中的二氧化碳 Ⅳ、Ⅲ、Ⅰ、Ⅱ g h e f a(或b) b(或a) c 防止空气中的水分和二氧化碳倒吸进入装置Ⅰ 先通一段时间的空气再加热Ⅰ装置
【解析】
使用金属钠和空气制备纯度较高的Na2O2必须出去空气中的H2O、CO2(Na2O2可以与H2O、CO2反应),采用Ⅳ装置中的氢氧化钠溶液先除去CO2,再经过Ⅲ装置浓硫酸除去H2O,连接Ⅰ 装置使金属钠和除杂后的氧气反应,最后连接Ⅱ装置,防止空气中的水和二氧化碳进入反应装置。
(1)装置Ⅳ吸收空气中的二氧化碳气体,所以装置Ⅳ中盛放NaOH溶液;
(2)依据上述分析,组合实验装置时各仪器的正确连接顺序为g,h接e,f接a,b接c;
(3)连接Ⅱ防止空气中的二氧化碳和水蒸气进入装置Ⅰ;
(4)实验时先通入足量空气后再进行加热,避免生成的过氧化钠和二氧化碳、水蒸气反应生成碳酸钠等杂质。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难落于水的物质,能熔于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按 照气流由左到右的方向,上述装置合理的连接顺序为a →____ →____ →f→g→_____ →____→d→e→j。(填仪器接口字母)_____________
(2)装置A中导管m的作用是________________________________。
(3)装置D中除生成TiCl4 外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________________________________。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:________________________________。
(5)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_______________。


