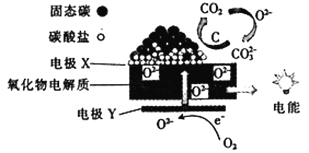
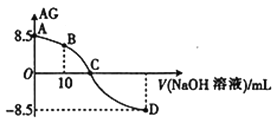
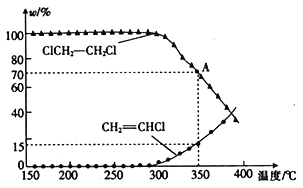
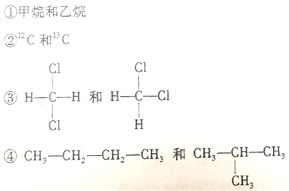
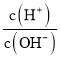题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
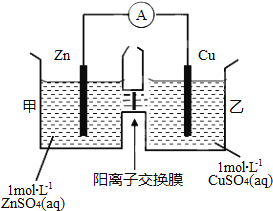
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】C
【解析】A. 活泼金属锌作负极,铜作正极,铜电极上发生还原反应,故A错误;B. 电池工作一段时间后,甲池的c(SO42-)不变,故B错误;C. 电池工作一段时间后,Cu2++2e-![]() Cu,同时Zn2+从左到右通过阳离子交换膜,所以乙池溶液的总质量增加,故C正确;D. 阳离子交换膜只允许阳离子和水分子通过,阴离子不能通过交换膜,故D错误。故选C。
Cu,同时Zn2+从左到右通过阳离子交换膜,所以乙池溶液的总质量增加,故C正确;D. 阳离子交换膜只允许阳离子和水分子通过,阴离子不能通过交换膜,故D错误。故选C。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难落于水的物质,能熔于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按 照气流由左到右的方向,上述装置合理的连接顺序为a →____ →____ →f→g→_____ →____→d→e→j。(填仪器接口字母)_____________
(2)装置A中导管m的作用是________________________________。
(3)装置D中除生成TiCl4 外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________________________________。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:________________________________。
(5)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_______________。