题目内容
4.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下).其中正确的是①pH=2的强酸溶液1mL,加水稀释至100mL后,溶液pH=4
②2L 0.25mol•L-1NH4Cl溶液与1L 0.50mol•L-1NH4Cl溶液含NH4+物质的量前者大
③pH=8.3的NaHCO3溶液中存在:HCO3-+H2O=H3O++CO32-
④CH3COOH、CH3COONa等体积混合一定存在,c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)( )
| A. | ①② | B. | ②③ | C. | ?①③ | D. | ②④ |
分析 ①1mL pH=2的H2SO4溶液加水稀释到100mL,c(H+)由0.01mol/L变为0.0001mol/L;
②NH4Cl浓度越小,NH4+水解程度越大,铵根离子的浓度小;
③碳酸氢钠属于弱酸的酸式盐,既有水解又有电离;
④若溶液中醋酸的浓度远大于醋酸钠的浓度,则c(CH3COOH)>c(Na+)结合电荷守恒分析;
解答 解:①1mL pH=2的强酸溶液加水稀释到100mL,溶液中氢离子浓度c(H+)由0.01mol/L变为0.0001mol/L,则稀释后溶液的pH=-lg0.0001=4,故①正确;
②溶液中弱电解质离子的浓度越小,水解程度越大,2L 0.25mol•L-1NH4Cl溶液与1L 0.50mol•L-1NH4Cl溶液,前者浓度小,水解程度大,所以氯化铵溶液中铵根离子的浓度前者小,故②错误;
③碳酸氢钠溶液中既有碳酸氢根的水解又有碳酸氢根离子的电离,碳酸氢根离子的电离为:HCO3-+H2O?H3O++CO32-,故③正确;
④CH3COOH、CH3COONa等体积混合,溶液呈电中性:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),若溶液中醋酸的浓度远大于醋酸钠的浓度,则c(CH3COOH)>c(Na+),c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+),故④错误;
故选C.
点评 本题考查pH与酸的稀释、盐类水解及溶液的电中性等,注意②水解规律中越稀越水解,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
13.已知温度T时KW=1.0×10-12,0.1mol/L Na2A溶液pH=6,则下列说法中,正确的是( )
| A. | 该温度下,0.005mol/L H2A溶液中水电离出的c(H+)=10-12mol/L | |
| B. | H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?A2-+H+ | |
| C. | (NH4)2A溶液中存在离子浓度关系:(NH4+)>(A2-)>(H+)>(OH-) | |
| D. | 等体积等浓度的盐酸与H2A溶液分别与5.6gFe反应,H2A产生的H2多 |
14.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | 只有③④ | D. | ①②③④⑤ |
9.某元素R的最高价氧化物的化学式为RO2,其气态氢化物中氢的质量分数为25%,此元素是( )
| A. | C | B. | N | C. | Si | D. | S |
13.下列离子方程式正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO${\;}_{3}^{-}$+NO↑+H2O | |
| B. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| C. | 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O | |
| D. | NH4HSO4溶液中加入等物质的量的Ba(OH)2溶液:NH4++H++SO42一+Ba2++2OH?=NH3•H2O+BaSO4↓+H2O |
14.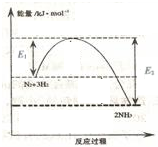 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
①前20min内,H2的反应速率为1.2×10-3mol/(L.min).
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).

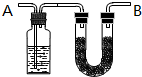 将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108.
将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. .
.