题目内容
2.已知反应方程式:NH4NO3+Zn═ZnO+N2↑+2H2O,下列有关说法中正确的是( )| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | ZnO是还原产物 | |
| C. | 氧化产物只有N2 | |
| D. | 该反应每生成1mol N2转移5mol电子 |
分析 NH4NO3+Zn=ZnO+N2↑+2H2O中,Zn元素的化合价升高,N元素的化合价由+5价降低为0,N元素的化合价由-3价升高为0,以此来解答.
解答 解:A.NH4NO3中N元素的化合价升高也降低,则既作氧化剂也作还原剂,故A错误;
B.Zn元素的化合价升高,失去电子被氧化,则ZnO为氧化产物,故B错误;
C.NH4NO3中-3价的N被氧化,Zn也被氧化,则氧化产物为ZnO和部分氮气,故C错误;
D.每生成1mol N2,1 moNH4lNO3转移电子由N元素的化合价升高可知,转移1mol×(5-0)=5mol电子,故D正确;
故选D.
点评 本题考查氧化还原反应,为高考常见题型,侧重氧化还原反应中基本概念的考查,把握元素的化合价变化即可解答,题目难度不大.

练习册系列答案
相关题目
12. 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
Na2B4O7•10H2O+2H2SO4+12CH3OH=2NaHSO4+4(CH3O)3B+17H2O
实验步骤:
在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7•10H2O(硼砂,式量382)然后缓慢地加入浓H2SO4并振荡;用电炉加热烧瓶中的液体;回流一段时间后,先接收51~55℃的馏分,再接收55~60℃的馏分;两次所得馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离;精馏得高纯硼酸三甲酯19.2g.
回答下列问题:
(1)图中仪器8的名称是锥形瓶,直形冷凝管冷却水应从a(填字母)接口进入.
(2)装有P2O3的干燥管作用是防止空气中水蒸气进入导致硝酸三甲酯水解.
(3)采用较高的甲醇与硼砂的物质的量之比的目的是提高硼砂的转化率.
(4)两次馏分中含硼酸三甲酯含量较高的是第1(填“1”或“2”)次.
(5)盐析后分离出硼酸三甲酯所需的主要玻璃仪器是分液漏斗.
(6)精馏时应收集68℃的馏分.
(7)本次实验的产率是D.
A.42.9% B.46.6% C.64.5% D.92.3%
 硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:
硼酸三甲酯可作溶剂、脱水剂和塑料、油漆、喷漆等的防火剂等.实验室合成硼酸三甲酯的反应、装置示意图及有关数据如下:Na2B4O7•10H2O+2H2SO4+12CH3OH=2NaHSO4+4(CH3O)3B+17H2O
| 硼酸三甲酯 | 甲醇 | |
| 相对分子量 | 104 | 32 |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 备注 | 硼酸三甲酯与甲醇能形成共沸混合物,沸点54℃ | |
在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7•10H2O(硼砂,式量382)然后缓慢地加入浓H2SO4并振荡;用电炉加热烧瓶中的液体;回流一段时间后,先接收51~55℃的馏分,再接收55~60℃的馏分;两次所得馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离;精馏得高纯硼酸三甲酯19.2g.
回答下列问题:
(1)图中仪器8的名称是锥形瓶,直形冷凝管冷却水应从a(填字母)接口进入.
(2)装有P2O3的干燥管作用是防止空气中水蒸气进入导致硝酸三甲酯水解.
(3)采用较高的甲醇与硼砂的物质的量之比的目的是提高硼砂的转化率.
(4)两次馏分中含硼酸三甲酯含量较高的是第1(填“1”或“2”)次.
(5)盐析后分离出硼酸三甲酯所需的主要玻璃仪器是分液漏斗.
(6)精馏时应收集68℃的馏分.
(7)本次实验的产率是D.
A.42.9% B.46.6% C.64.5% D.92.3%
10.A、B、C、D是4种短周期元素,已知A、C同主族,B、C、D同周期,A的气态氢化物比C的气态氢化物稳定,B的阳离子比D的阳离子氧化性强,B的阳离子比C的阴离子少一个电子层.下列有关说法中,不正确的是( )
| A. | 原子序数 C>B>D>A | B. | 单质熔点 D>B,A>C | ||
| C. | 原子半径 D>B>C>A | D. | 简单离子半径 C>A>D>B |
17.下列变化过程中,克服了分子间作用力的是( )
| A. | 食盐熔化 | B. | 氯化氢溶于水 | C. | 干冰气化 | D. | 金属钠熔化 |
7.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料,下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 | |
| D. | ${\;}_{92}^{238}$Pu与${\;}_{92}^{239}$Pu具有相同的最外层电子 |
12.在下列各组离子中,能大量共存的是( )
| A. | Al3+、H+、AlO2-、Cl- | B. | Cu2+、Fe2+、ClO-、SO42- | ||
| C. | Na+、Ca2+、HCO3-、Cl- | D. | Cu2+、Fe3+、Cl-、NO3- |

 .
. .
. .
.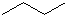
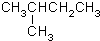
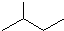 CH3CH=CHCH3
CH3CH=CHCH3
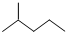 分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷
分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷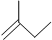 分子式C5H10③
分子式C5H10③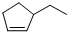 分子式C7H12
分子式C7H12