题目内容
11.含铝90%的铝合金1.5g与40mL6mol/L盐酸充分反应,合金中其它成分不反应.过滤除去不溶物,并将滤液稀释到200mL,取出稀释液l0mL,加入0.3mol/L的氨水使Al 3+完全沉淀.(1)铝和盐酸反应生成的氢气有多少L(标准状况)?
(2)使Al3+完全沉淀所需的氨水要多少mL?
分析 (1)合金中Al的物质的量=$\frac{1.5g×90%}{27g/mol}$=0.05mol,n(HCl)=0.04×6mol/L=0.24mol,由2Al+6HCl═2AlCl3+3H2↑,可知0.05molAl完全反应消耗0.15mol HCl,小于0.24mol,故HCl有剩余,根据Al计算生成氢气体积;
(2)反应后的溶液中加入氨水,使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n(HCl),再根据N原子守恒计算n(NH3),进而计算消耗氨水的体积.
解答 解:(1)合金中Al的物质的量=$\frac{1.5g×90%}{27g/mol}$=0.05mol,n(HCl)=0.04L×6mol/L=0.24mol,则:
2Al+6HCl═2AlCl3+3H2↑,
0.05mol 0.15mol
Al完全反应消耗0.15molHCl,小于0.24mol,故HCl有剩余,由方程式可知,生成氢气物质的量=0.05mol×$\frac{3}{2}$=0.075mol,
故生成氢气的体积=0.075mol×22.4L/mol=1.68L,
答:铝和盐酸反应生成的氢气有1.68L;
(2)滤液稀释到200mL,取出稀释液10mL,加入0.3mol•L-1的氨水使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n′(HCl)=0.24mol×$\frac{10mL}{200mL}$=0.012mol,再根据N原子守恒可知n(NH3)=0.012mol,
故需要氨水的体积=$\frac{0.012mol}{0.3mol/L}$=0.04L=40mL,
答:使Al3+完全沉淀所需的氨水要40mL.
点评 本题考查了有关化学方程式的计算,题目难度中等,注意把握过量计算与守恒思想的应用,侧重于考查学生的分析能力和计算能力.

| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | ZnO是还原产物 | |
| C. | 氧化产物只有N2 | |
| D. | 该反应每生成1mol N2转移5mol电子 |
| A. | 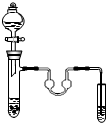 苯的溴代反应 | B. | 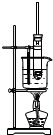 苯的硝化反应 | C. | 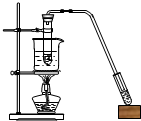 制取乙酸乙酯 制取乙酸乙酯 | D. | 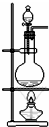 制取乙烯 |
| A. | 金属镁与盐酸反应 | B. | 石灰石高温分解 | ||
| C. | 盐酸与氢氧化钠溶液反应 | D. | 二氧化硫和氧气生成三氧化硫 |
| A. | 小于0.90 mol | B. | 等于0.90 mol | ||
| C. | 在0.90~1.80 mol之间 | D. | 大于0.90 mol |

| A. | 图1为证明S、C、Si元素的非金属性强弱的装置 | |
| B. | 图2为可随开随停制备少量氧气的装置 | |
| C. | 图3为配制100mL一定浓度硫酸溶液 | |
| D. | 图4制备并收集少量NO2气体 |
| A. | 甲烷、辛醛 | B. | 乙醇、苯乙烯 | C. | 乙酸乙酯、甲酸 | D. | 丙炔、苯 |
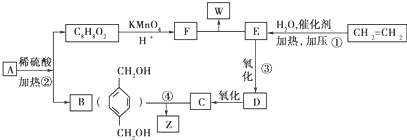
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.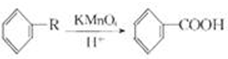 ,
,
 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.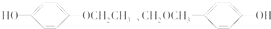 、
、 、
、 .
.