题目内容
10.A、B、C、D是4种短周期元素,已知A、C同主族,B、C、D同周期,A的气态氢化物比C的气态氢化物稳定,B的阳离子比D的阳离子氧化性强,B的阳离子比C的阴离子少一个电子层.下列有关说法中,不正确的是( )| A. | 原子序数 C>B>D>A | B. | 单质熔点 D>B,A>C | ||
| C. | 原子半径 D>B>C>A | D. | 简单离子半径 C>A>D>B |
分析 A、B、C、D是4种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、D为非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C,据此解答.
解答 解:A、B、C、D是4种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、D为非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C.
A.由上述分析可知,原子序数 C>B>D>A,故A正确;
B.B与D为金属晶体,而B的阳离子电荷较大、离子半径较小,金属更强,故熔点B>D;A、C单质熔点:可能A<C,如B为氧气、C为硫,可能为A>C,如A为金刚石、B为晶体硅,故B错误;
C.同周期从左到右元素原子半径逐渐减小,所以原子半径:D>B>C,同主族从上到下原子半径逐渐增大,所以原子半径C>A,故原子半径:D>B>C>A,故C正确;
D.A、B、D的核外电子排布相同,C的核外电子排布相同比A、B、C多一个电子层,电子层数越多,离子半径越大,故C阴离子半径最大.核外电子排布相同时,核电荷数越大,离子的半径越小,原子序数:B>D>A,所以离子半径:C>A>D>B,故D正确;
故选B.
点评 本题考查位置结构性质关系应用,关键是确定元素的相对位置关系,注意对元素周期律理解掌握,注意B选项中晶体熔沸点的比较,难度中等.

①甲基环己烷 ②间二甲苯 ③对二甲苯 ④乙苯⑤2,2-二甲基丁烷.
| A. | ②③ | B. | ①④ | C. | ④⑤ | D. | ③⑤ |
| A. | 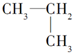 与 与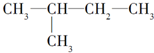 | B. |  与 与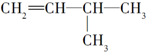 | ||
| C. | HO-CH2-CH2-OH与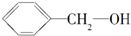 | D. | 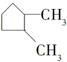 与 与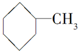 |
| A. | 燃烧一定要有氧气参加 | B. | 有发光现象的变化一定是燃烧 | ||
| C. | 燃烧一定有发光发热现象 | D. | 燃烧的生成物一定有气体 |
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | ZnO是还原产物 | |
| C. | 氧化产物只有N2 | |
| D. | 该反应每生成1mol N2转移5mol电子 |
| A. | 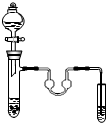 苯的溴代反应 | B. | 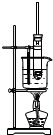 苯的硝化反应 | C. | 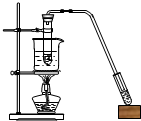 制取乙酸乙酯 制取乙酸乙酯 | D. | 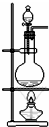 制取乙烯 |
| A. | 甲烷、辛醛 | B. | 乙醇、苯乙烯 | C. | 乙酸乙酯、甲酸 | D. | 丙炔、苯 |
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.