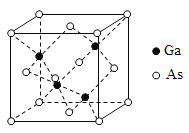
题目内容
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是
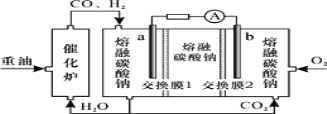
A.O2在b极得电子,最终被还原为CO32
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32经“交换膜2”移向b极
D.H2参与的电极反应为:H22e+CO32=H2O+CO2
【答案】C
【解析】
在燃料电池中,通入氧气的一极为正极,则b极为正极,a极为负极,电解质为熔融碳酸钠,正极发生还原反应,电极反应式为:O2 + 4e + 2CO2=2CO32,负极反应物为H2、CO,失电子发生氧化反应,分别生成水和二氧化碳,H2参与的电极反应为:H22e+CO32=H2O+CO2,CO参与的电极反应为:CO2e+CO32=2CO2,原电池外电路中电子沿导线由负极流向正极,内电路中阴离子移动向负极,阳离子移动向正极,据此分析。
A. 通入氧气的一极为正极,发生还原反应,所以O2在b极得电子,最终被还原为CO32,故A正确;
B. 原电池中电子沿导线由负极流向正极,b极为正极,a极为负极,所以放电过程中,电子由电极a经导线流向电极b,故B正确;
C. 原电池中阴离子向负极移动,所以CO32经“交换膜2”移向a极,故C错误;
D. 负极氢气发生氧化反应,电极反应式:H22e + CO32 = H2O + CO2,故D正确;
故选:C。

 阅读快车系列答案
阅读快车系列答案【题目】室温下(20oC))课外小组用下列装置探究铁和硝酸反应情况,过程如下图所示:

将Ⅲ中液面上的气体排入小试管中点燃,有尖锐爆鸣声,小试管壁出现液滴。取反应后溶液,加入足量NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气带有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)X气体是______ (填化学式),证据是________。
(2)实验中硝酸被还原成另一种产物的化学方程式_____。
(3)甲同学对产生的气体原因提出假设并设计方案:
假设1:该浓度的硝酸中H+的氧化性大于NO3-
假设2:H+还原反应速率大于NO3-的还原反应速率
I. 验证假设1:可用____(选 “ Cu” 或“Zn”)粉与同浓度硝酸反应,依据 ____________ ,则假设1不成立。
II. 验证假设2:改变条件重复上图过程实验,结果如下:(所用试剂的量、气体成分与实验上图相同)
序号 | 反应温度 | 实验结果 |
a | 40oC | 溶液浅绿色,收集气体为3.4mL |
b | 60oC | 溶液浅绿色,收集气体为2.6mL |
上表实验结果_____(填“能”或“否”)判断假设2成立。由实验数据结果分析温度对铁粉与硝酸反应时对生成X体积的影响的原因___________。
(4)常温下(20℃),乙同学改用3mol·L–1 HNO3 进行图1过程实验,Ⅱ中仍为无色气体,在Ⅲ中气体变红色。由此得出的相关结论正确的是______ 。
a. 该实验产生的无色气体只有NO
b. 若改用浓硝酸时,反应会更剧烈还原产物为NO2
c. 硝酸的浓度不同时,其主要还原产物不同
(5)综上所述,金属与硝酸生成X气体,需要控制的条件是___________ 。