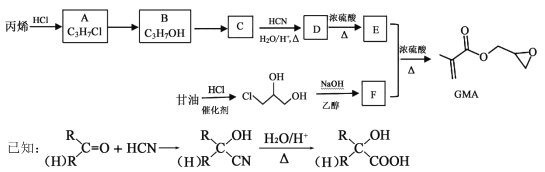
题目内容
【题目】[化学——选修3:物质结构与性质]
铜、镓、砷等元素形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的核外电子占有的能级数为________,轨道数为________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)铜与CN-可形成络合离子[Cu(CN-)4]2-,写出一种与CN-等电子体的分子化学式________;若将[Cn(CN-)4]2-中二个CN-换为Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间位置关系为________。
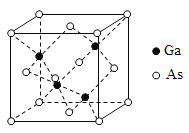
(5)GaAs的熔点为1238C,密度为p g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
【答案】7 15 大于 小于 三角锥形 sp3 N2或CO 正四面体 原子晶体 共价 ![]()
【解析】
(1)基态铜的电子排布为1s22s22p63s23p63d104s1, 所以有7个能级,轨道数为15;
(2) Ga和As位于第四周期,前者核电荷数小,所以根据元素周期律分析,同周期元素,随着核电荷数增大,半径减小,第一电离能增大;
(3) AsCl3分子中As原子价层电子对个数为![]() =4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的李体构型为三角锥形,As原子杂化类型为sp3;
=4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的李体构型为三角锥形,As原子杂化类型为sp3;
(4)等电子体是指原子总数相同,价电子总数也相同的微粒,根据CN-分析,可以是N2或CO;若将[Cn(CN-)4]2-中二个CN-换为Cl-,只有一种结构,说明则[Cu(CN-)4]2-中CN-处于相同的位置,即4个氮原子所处空间位置关系为正四面体;
(5) GaAs的熔点为1238C,熔点较高,以共价键结合形成的属于原子晶体,密度为p g·cm-3,根据均摊法计算,As的个数为![]() ,Ga的个数为4×1=4,故其晶胞中原子所占的体积V1=
,Ga的个数为4×1=4,故其晶胞中原子所占的体积V1= ![]() ,晶胞的体积V2=
,晶胞的体积V2= 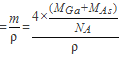 ,故GaAs晶胞中原子的体积的百分率为V1/V2×100%,将V1、V2带入计算得百分率
,故GaAs晶胞中原子的体积的百分率为V1/V2×100%,将V1、V2带入计算得百分率 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。
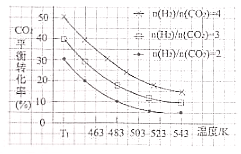
结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。