题目内容
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
(1)Cl2O;第二周期第ⅤA族
(2)2HClO=2HCl+O2
(3)3Cl2O+10NH3=6NH4Cl+2N2+3H2O; 氧化
(4)2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(5)取少量晶体溶于水,分成两份于试管中;一份加入浓NaOH溶液、加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+;另一份加入用硝酸酸化的硝酸银溶液,产生白色沉淀,证明含Cl-,由此证明该晶体为NH4Cl。A与氨气生成离子晶体C,C是NH4Cl,由于氯元素的化合价发生变化,氨气中的氮化合价必然升高,其氧化产物是N2,这利用了A的氧化性
(2)2HClO=2HCl+O2
(3)3Cl2O+10NH3=6NH4Cl+2N2+3H2O; 氧化
(4)2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(5)取少量晶体溶于水,分成两份于试管中;一份加入浓NaOH溶液、加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+;另一份加入用硝酸酸化的硝酸银溶液,产生白色沉淀,证明含Cl-,由此证明该晶体为NH4Cl。A与氨气生成离子晶体C,C是NH4Cl,由于氯元素的化合价发生变化,氨气中的氮化合价必然升高,其氧化产物是N2,这利用了A的氧化性
本题是元素及化合物综合运用题。A的相对分子质量为29×3=87,而Cl的相对原子质量为35.5,所以Cl原少至少为2个,这样O为1个,A合理的分子式为Cl2O;根据化合价规律,A溶于水生成弱酸B为HClO;值得注意的是A和氨反应方程式的书写,是近几年高考考查能力最多的一种体验,要用心学会如何书写。另外最后一问是“离子晶体”证明设计,要设法证明既有NH4+又有Cl-离子存在,这才是完全理解题意,设计步骤要完整规范。

练习册系列答案
相关题目
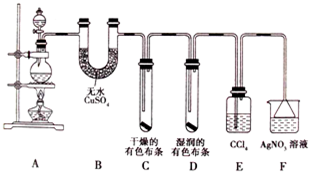
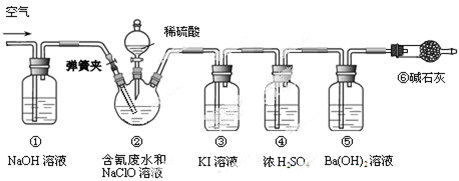
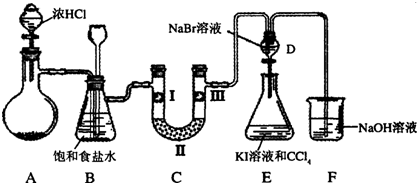
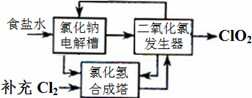
 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).