题目内容
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
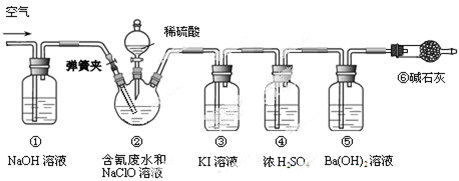
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。

已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。
(1)排除空气中CO2对实验的干扰
(2)ClO-+Cl-+2H+=Cl2↑+H2O
(3)使装置内残留的CO2全部进入装置⑤而被吸收
(4)装置⑤反应前后的质量或沉淀
(5)0.4L
(2)ClO-+Cl-+2H+=Cl2↑+H2O
(3)使装置内残留的CO2全部进入装置⑤而被吸收
(4)装置⑤反应前后的质量或沉淀
(5)0.4L
(1)①和⑥的作用是排除空气中CO2对实验的干扰。
(2)已知反应条件,有氯离子生成,又次氯酸有很强的氧化性,所以,ClO-+Cl-+2H+=Cl2↑+H2O。
(3)使装置中残留的CO2全部进入装置⑤而被吸收。
(4)通过测定碱石灰的质量的变化测得CO2的质量,根据关系式计算含氯废水处理百分率,则需要测定装置⑤反应前后的质量。
(5)由CN-+ClO-=CNO-+Cl- 2CNO-+2H++3ClO-=N2+2CO2+3Cl-+H2O,又因为
n(CN-)=0.02mol,转化率为0.9。由关系式可知,产生的CO2的体积是0.4L。
(2)已知反应条件,有氯离子生成,又次氯酸有很强的氧化性,所以,ClO-+Cl-+2H+=Cl2↑+H2O。
(3)使装置中残留的CO2全部进入装置⑤而被吸收。
(4)通过测定碱石灰的质量的变化测得CO2的质量,根据关系式计算含氯废水处理百分率,则需要测定装置⑤反应前后的质量。
(5)由CN-+ClO-=CNO-+Cl- 2CNO-+2H++3ClO-=N2+2CO2+3Cl-+H2O,又因为
n(CN-)=0.02mol,转化率为0.9。由关系式可知,产生的CO2的体积是0.4L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目