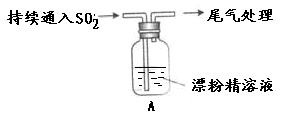
题目内容
下列关于氯水的说法正确的是
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
C
试题分析:A、向氯水中通入少量二氧化硫发生氧化还原反应生成盐酸和硫酸,氯水的漂白性减弱,A不正确;B、氯水中加入NaCl固体,溶液中氯离子浓度增大,则使平衡H2O+Cl2
 H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
练习册系列答案
相关题目