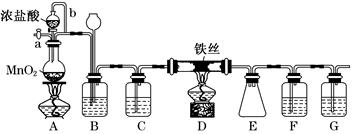
题目内容
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
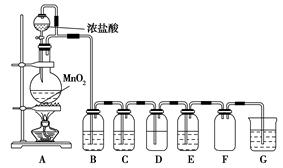
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
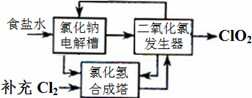
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4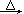 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。

(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4
 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O(5)反应中的Na2SO3溶液中存在如下平衡:H2O
 H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
(1)H2、Cl2 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;能耗较大等
(3)1C6H12O6+24NaClO3+12H2SO4→24ClO2↑+6CO2↑+18H2O+12Na2SO4, 0.16NA,
(4)2.5
(5)SO32- +H2O
 OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O OH-+H2SO3;Na+ SO32- OH- HSO3- H +
OH-+H2SO3;Na+ SO32- OH- HSO3- H +(6)NaHSO3、Na2SO3、 NaCl、或(NaHSO3、Na2SO3、 NaCl、SO2、H2SO3)
试题分析:
(1)有工艺流程图可以看出:在该工艺中可利用的单质有H2、Cl2 。根据流程图、质量守恒定律及电子守恒规律可得出在发生器中生成ClO2的化学方程式为: 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)由 制备原理和流程图可知此法的缺点主要是会产生大量的Cl2,消耗大量的电能,产物ClO2和Cl2不仅不容易分离,而且物质利用率低,很容易造成大气污染。
(3)纤维素水解得到的最终产物X是葡萄糖C6H12O6。它与NaClO3在酸性条件下发生反应,根据质量守恒定律和电子守恒的知识可得方程式为1C6H12O6+24NaClO3+12H2SO 4→24ClO2↑+6CO2↑ +18H2O+ 12Na2SO4,由方程式可以看出每产生30mol的气体,转移电子24NA。现在产生气体颚物质的量为4.48L ÷22.4L/mol=0.2mol。所以转移电子的物质的量为24NA÷30×0.2="0.16" NA
(4)处理含CN—相同量的电镀废水,即转移电子的物质的量相同。假设转移电子2mol,则需要Cl2的物质的量是1mol;需要ClO2的物质的量为2÷=0.4mol。所以n(Cl2): n(ClO2)=1:0.4=2.5。
(5)反应中的Na2SO3溶液中存在如下平衡:H2O
 H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O
H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O  OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O  OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。(6)在Na2SO3溶液中滴加稀盐酸若恰好发生反应:Na2SO3+HCl=NaCl+NaHSO3。则由于NaHSO3溶液呈酸性。所以至中性时,n(HCl)<n(Na2SO3).产生溶液中含有的溶质有未反应的Na2SO3及反应生成的NaCl、NaHSO3。溶质有Na2SO3、NaCl、NaHSO3。也可能滴加HCl局部过量会产生SO2、H2SO3溶解在该溶液中还含有SO2和H2SO3。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目