题目内容
16.下列各项中表达正确的是( )| A. | N2的结构式::N≡N: | B. | F-离子结构示意图: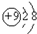 | ||
| C. | 用电子式表示HCl形成过程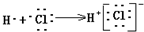 | D. | 次氯酸电子式 |
分析 A.氮气的结构式中不需要标出未成键电子对;
B.氟离子的核电荷数为9,核外电子总数为10,最外层达到8电子稳定结构;
C.氯化氢为共价化合物,不存在阴阳离子;
D.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键.
解答 解:A.氮气中存在氮氮三键,用短线代替所有的共用电子对即为结构式,氮气正确的结构式为:N≡N,故A错误;
B.氟离子的核电荷数为9,最外层达到8电子稳定结构,氟离子结构示意图为: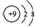 ,故B正确;
,故B正确;
C.氯化氢为共价化合物,分子中不存在阴阳离子,正确的氯化氢形成过程为 ,故C错误;
,故C错误;
D.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故D错误,
,故D错误,
故选B.
点评 本题考查了电子式、离子结构示意图、结构式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确离子结构示意图与原子结构示意图、离子键与共价键的电子式的区别,试题考查了学生规范答题的能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
6.已知:H2(g)+F2(g)═2HF(g);△H=-270kJ/mol,下列说法正确的是( )
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 该反应中的能量变化可用如图来表示 |
7. 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol•L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是abd(填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)=c(SO32-)-c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
①在阳极区发生的反应中的非氧化还原反应的离子方程式为4OH--4e-═2H2O+O2↑.
②简述CO32-在阴极区再生的原理HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
已知键能:C-H键:413.4kJ.mol-l.H-H键:436.0kJ•mol-1,请计算:
①2CH4(g)=C2H2(g)+3H2(g)△H=376.4 kJ•mol-1
②C2H2中-C≡C-的键能为796.0 kJ/molkJ•mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为CH4+4CO32--8e-=5CO2+2H2O.
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol•L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是abd(填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)=c(SO32-)-c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
①在阳极区发生的反应中的非氧化还原反应的离子方程式为4OH--4e-═2H2O+O2↑.
②简述CO32-在阴极区再生的原理HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
①2CH4(g)=C2H2(g)+3H2(g)△H=376.4 kJ•mol-1
②C2H2中-C≡C-的键能为796.0 kJ/molkJ•mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为CH4+4CO32--8e-=5CO2+2H2O.
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
4.某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X可能形成化学式为KXO3的盐 |
11.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法正确的是( )
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率,对逆反应速率无影响 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
1.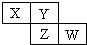 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
5.下列性质中,可以证明某化合物形成的晶体一定是离子晶体的是( )
| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
6.下列关于铜-锌-稀硫酸构成的原电池的有关叙述,错误的是( )
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
