题目内容
4.某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X可能形成化学式为KXO3的盐 |
分析 核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,若n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,符合题意;n=3时,最外层电子数为7,质子数为17,符合题意,以此来解答.
解答 解:核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1,若n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,符合题意;n=3时,最外层电子数为7,质子数为17,符合题意.
A.A为N或Cl元素,最外层电子数分别为5、7,核电荷数分别为7、17,均为奇数,故A正确;
B.N元素能与金属Mg元素形成化合物Mg3N2,Cl元素能与金属Na元素形成化合物NaCl,故B正确;
C.由于元素X可能为N元素或Cl元素,因此不可能形成X(OH)3的碱,故C错误;
D.元素X可能为N元素或Cl元素,可形成KNO3或KClO3,故D正确;
故选C.
点评 本题考查原子结构与元素性质关系,利用假设法令n分别为1、2、3来讨论即可解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.反应A+3B═2C+2D 在四种不同条件下的反应速率为:( )
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
| A. | (4)>(1)>(2)=(3) | B. | (2)>(1)>(4)=(3) | C. | (1)>(4)>(2)=(3) | D. | (3)>(4)>(2)=(1) |
9.下列说法正确的是( )
| A. | 乙烯和乙烷都能在空气中燃烧而被氧气氧化,具有强还原性,所以它们也能被强氧化剂高锰酸钾氧化 | |
| B. | 苯和乙烯都易发生加成反应,乙烷能发生取代反应 | |
| C. | 将苯与浓硝酸混合共热可制得硝基苯,属加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
16.下列各项中表达正确的是( )
| A. | N2的结构式::N≡N: | B. | F-离子结构示意图: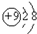 | ||
| C. | 用电子式表示HCl形成过程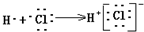 | D. | 次氯酸电子式 |
13.下列关于实验现象的描述正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡 | |
| B. | 用锌片做阳极铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把少量锌粒放入盛有足量的盐酸试管中,加几滴氯化铜溶液,气泡放出速率加快,生成氢气的总量不变 |

 (写结构简式).
(写结构简式). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
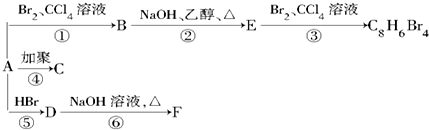
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$
 ,B的结构简式
,B的结构简式 或
或 .
. ,
, 、
、 、
、 、
、 .
.