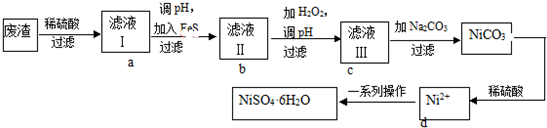
题目内容
1. 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了.
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象.
③98%的浓硫酸物质的量浓度为18.4mol•L-1,密度为1.84g•cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10-15滴(约0.5mL),加热至沸腾,该试管中液体是否有有明显变化无
.试用数据解释原因H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象.
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色.
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应.所观察到与甲不同的现象是液体无色或浅蓝色,有白色固体在试管底部析出原因是98%浓H2SO4有吸水性,生成无水CuSO4.为了最终看到与甲类似的现象,乙同学需进行的操作是待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌.
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是Cu2S或硫化铜或Cu2S与硫化铜的混合物.
分析 (1)98%的浓H2SO4 0.5mL与3mL水混合后溶液的质量分数为$\frac{0.5mL×1.84g/ml×98%}{0.5mL×1.84g/mL+3g}$×100%=23%,60%以下的H2SO4氧化性较弱,不与铜反应;
(2)计算出加入再10mL浓硫酸后溶液中硫酸的质量分数,然后判断是否反应及反应现象;
(3)浓硫酸具有吸水性,将硫酸铜变成无水硫酸铜,据此判断反应现象;可以将冷却后的溶液加入盛有水的烧杯中观察;
(4)根据铜与浓硫酸反应可能生成黑色的Cu2S或硫化铜分析.
解答 解:(1)98%的浓H2SO4 0.5mL与3mL水混合后溶液的质量分数为:$\frac{0.5mL×1.84g/ml×98%}{0.5mL×1.84g/mL+3g}$×100%=23%,小于60%,60%以下的H2SO4氧化性较弱,与铜不反应,所以没有明显现象,
故答案为:无;H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象;
(2)甲同学再用分液漏斗加浓硫酸10mL,此时硫酸的质量分数为:$\frac{10.5mL×1.84g/mL×98%}{10.5mL×1.84g/mL+3g}$×100%=86.3%>60%,所以加热后浓硫酸与铜发生反应,现象为:铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色,
故答案为:铜片慢慢溶解,带支管的试管中溶液渐成蓝色,小试管中品红褪色;
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应,由于原因是98%浓H2SO4有吸水性,生成无水CuSO4,则会观察到液体无色或浅蓝色,有白色固体在试管底部析出;为了最终看到与甲类似的现象,应该待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌,
故答案为:液体无色或浅蓝色,有白色固体在试管底部析出;98%浓H2SO4有吸水性,生成无水CuSO4;待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌;
(4)铜与浓硫酸反应可能生成Cu2S或硫化铜,所以黑色物质可能为Cu2S或硫化铜或Cu2S与硫化铜的混合物,
故答案为:Cu2S或硫化铜或Cu2S与硫化铜的混合物.
点评 本题考查了性质实验方案的设计,题目难度中等,明确题干信息及实验目的为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力,(1)为易错点,需要通过计算结果进行判断,注意掌握性质实验方案设计与评价原则.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
(已知Ksp[Fe(OH)3]=3.8×10-38; Ksp[Cu(OH)2]=2×10-20;Ksp(ZnS)=1.6×10-24)
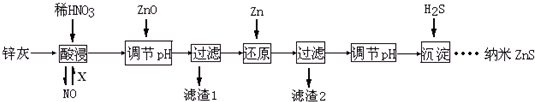
下列说法不正确的是( )
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
| A. | 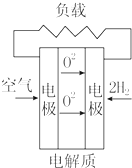 固体氧化物燃料电池 | B. | 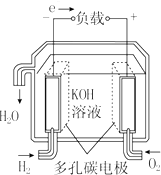 碱性燃料电池 | ||
| C. | 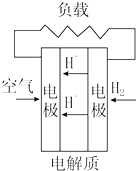 质子交换膜燃料电池 | D. | 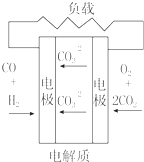 熔融盐燃料电池 |
| A. | 食盐 | B. | 香醋 | C. | 植物油 | D. | 黄酒 |