题目内容
【题目】煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) H = +135 kJ mol-1 ,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) H =-41 kJ mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写岀碳和二氧化碳反应生成一氧化碳的热化学方程式_____。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。

若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的 物质的量之比为1:3,则反应②所对应的温度是_____(填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)2H2O(g)+4CO(g);CH4(g)+H2O(g)CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
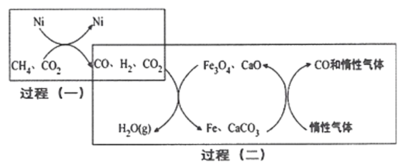
①过程(二)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(一)和过程(二)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(一)和过程(二)中均含有氧化还原反应
b.过程(二)中使用的催化剂为Fe3O4和CaCO3
C.若过程(一)投料比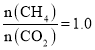 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____(用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____(用平衡分压代替平衡浓度计算)。
【答案】氧气与碳发生燃烧反应放热,放出的热被可逆反应吸收利用,促进反应正向移动 C(s)+CO2(g)=2CO(g) H=+176kJ/mol T3 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac ![]() 4.32×10-2(MPa)2
4.32×10-2(MPa)2
【解析】
根据碳与氧气反应放出热量,会引起C(s) + H2O(g)=CO(g) + H2(g) H = +135 kJ mol-1平衡移动,就可分析解答;对于本题(3)由已知n(H2O)/n(CO)为0.8,可假设水蒸气为4mol,则CO为5mol,根据CO(g)+H2O(g)=CO2(g)+ H2(g)求出CO的平衡转化率即可解答。对于本题(4)根据甲烷—二氧化碳重整的催化转化原理图示,找出过程(一)和过程(二)发生的反应就可解答。
(1)C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol1,是吸热反应,而碳与氧气反应放出热量,使反应C(s)+H2O(g)CO(g)+H2(g),向正反应方向移动,提高碳的利用率;答案为氧气与碳发生燃烧反应放热,放出的热被可逆反应C(s)+H2O(g)CO(g)+H2(g)吸收利用,促进反应正向移动。
(2)由①:C(s) + H2O(g)=CO(g) + H2(g) H = +135 kJ mol-1 ,②:CO(g)+H2O(g)=CO2(g)+ H2(g) H =-41 kJ mol-1,根据盖斯定律,用①-②可得出:C(s)+CO2(g)=2CO(g) H=+135 kJ mol-1-(-41 kJ mol-1)=+176 kJ mol-1;答案为C(s)+CO2(g)=2CO(g) H=+176 kJ mol-1;
(3)如图:若n(H2O)/n(CO)为0.8,设水蒸气的物质的量是4mol、则①生成的CO物质的量为5mol,同时生成5mol氢气, 经煤气化反应①和水气变换反应②后,设反应②中CO变化了xmol,则生成xmol氢气,则(5x): (5+x)=1:3,x=2.5mol,CO的转化率= ![]() ×100%=50%,根据图知,反应温度为T3;答案为T3。
×100%=50%,根据图知,反应温度为T3;答案为T3。
(4)①由上述图可知,过程(一)的产物CO、H2、和过量的CO2进入过程(二)中,与过程(二)中的Fe3O4、CaO混合发生反应,实现了含氢物种与含碳物种的分离,生成H2O(g)的反应显然是H2与Fe3O4反应,则化学方程式为:Fe3O4+4H2 ![]() 3Fe+4H2O;答案为Fe3O4+4H2
3Fe+4H2O;答案为Fe3O4+4H2 ![]() 3Fe+4H2O。
3Fe+4H2O。
②a.过程(一):CH4+CO2(g) ![]() 2H2(g)+2CO,碳、氢元素化合价发生变化,属于氧化还原反应,过程(二):4H2+Fe3O4
2H2(g)+2CO,碳、氢元素化合价发生变化,属于氧化还原反应,过程(二):4H2+Fe3O4![]() 3Fe+4H2O,氢、铁元素化合价发生变化,属于氧化还原反应,过程(一)和过程(二)中均含有氧化还原反应,故a正确;
3Fe+4H2O,氢、铁元素化合价发生变化,属于氧化还原反应,过程(一)和过程(二)中均含有氧化还原反应,故a正确;
b.过程(二)中CaCO3是CaO与CO2发生化学反应生成的,不符合催化剂的概念,CaO才是催化剂,故b错误;
c.若过程(一)投料比 ,CH4与CO2刚好反应,CO2无剩余,则催化剂CaO在过程(二)中没有二氧化碳与之反应生成CaCO3,催化剂失效,故c正确;答案为ac。
,CH4与CO2刚好反应,CO2无剩余,则催化剂CaO在过程(二)中没有二氧化碳与之反应生成CaCO3,催化剂失效,故c正确;答案为ac。
(5)已知n(H2O)/n(CH4)为1.0,可假设n(H2O)=n(CH4)=1mol,操作压强为0.1Mpa,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6,设达平衡时CH4变化了xmol,
根据H2的物质的量分数= ![]() =0.6,求出x=
=0.6,求出x=![]() mol,则CH4的物质的量分数=
mol,则CH4的物质的量分数= ![]() =0.1,由反应的速率方程v=kP(CH4)P-1(H2)=k·
=0.1,由反应的速率方程v=kP(CH4)P-1(H2)=k·![]() = k·
= k·![]() =
=![]() ,同理可求出H2O的物质的量分数为0.1,CO的物质的量分数为0.2;根据气体分压=总压×气体物质的量分数,总压为0.1Mpa ,则P(CO)=0.1×0.2MPa,P(H2)=0.1×0.6MPa,P(CH4)=0.1×0.1MPa,P(H2O)=0.1×0.1MPa,在900℃时,该反应的压强平衡常数Kp=
,同理可求出H2O的物质的量分数为0.1,CO的物质的量分数为0.2;根据气体分压=总压×气体物质的量分数,总压为0.1Mpa ,则P(CO)=0.1×0.2MPa,P(H2)=0.1×0.6MPa,P(CH4)=0.1×0.1MPa,P(H2O)=0.1×0.1MPa,在900℃时,该反应的压强平衡常数Kp=![]() =
=![]() =4.32×10-2(MPa)2;答案为
=4.32×10-2(MPa)2;答案为![]() ,4.32×10-2(MPa)2。
,4.32×10-2(MPa)2。

【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。