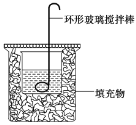
题目内容
【题目】实验室制备硝基苯的反应装置如图所示。下列实验操作或叙述错误的是( )。
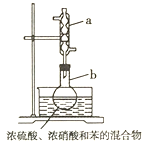
A.实验时水浴温度需控制在50~60℃
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,最后加入苯
C.仪器![]() 的作用:冷凝回流苯和硝酸,提高原料的利用率
的作用:冷凝回流苯和硝酸,提高原料的利用率
D.完全反应后,可用仪器![]() 、
、![]() 蒸馏得到产品
蒸馏得到产品
【答案】D
【解析】
A.硝酸与苯在浓硫酸催化作用下,加热到5060℃发生取代反应生成硝基苯,故A正确;
B.在将浓硫酸与其它液体混合时,要将浓硫酸注入其它液体中,故先将浓HNO3注入试管中,然后再慢慢注入浓H2SO4,并及时搅拌,浓硝酸和浓硫酸混合后,在5060℃的水浴中冷却后再滴入苯,故B正确;
C.苯与浓硝酸易挥发,仪器![]() 是冷凝管,作用是冷凝回流苯和硝酸,提高原料的利用率,故C正确;
是冷凝管,作用是冷凝回流苯和硝酸,提高原料的利用率,故C正确;
D.反应后的混合液经水洗、碱溶液洗涤除去硝酸、硫酸等杂质,然后蒸馏除去苯,得到硝基苯,蒸馏时应使用直形冷凝管,故D错误;
答案选D。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
【题目】依据下列实验现象,所得结论不正确的是
实验 | 实验现象 |
| ①品红溶液红色褪去,经检验溶液中含有SO42- ②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。 |
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液