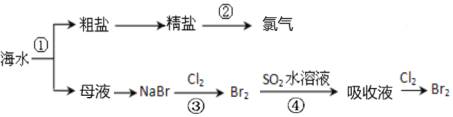
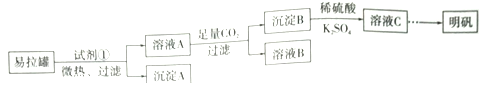
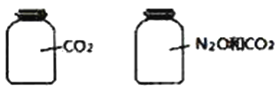
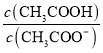��Ŀ����
����Ŀ����Na��Ũ��Ϊ0.5mol��L��1��ij������Һ�У������ܺ����±��е����������ӡ�
������ | K�� Ag�� Mg2�� Ba2�� |
������ | NO3- CO32- Cl- SO42- |
��ȡ����Һ100mL��������ʵ��(����������ڱ�״���²ⶨ)��
��� | ʵ������ | ʵ���� |
�� | �����Һ�м�������ϡ���� | �ų���״����0.56L��ɫ���� |
�� | ���ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù������� | ��������Ϊ9.32�� |
�� | ������Һ�еμ���������Һ | ���������� |
��ش��������⡣
��1��ʵ�����ȷ��һ�������ڵ�������___��
��2��ʵ�����������������ӷ���ʽΪ___��
��3��ͨ��ʵ���ͱ�Ҫ���㣬��д�±��������ӵ�Ũ��(�ܼ�����ģ���д��������һ�������ڵ���������0��������ȷ���Ƿ���ڵ����������)��___
������ | NO3- | CO32- | Cl- | SO42- |
c/mol��L��1 |
��4���ж�K���Ƿ���ڣ�������������СŨ�ȣ���������˵�����ɣ�___��
���𰸡�Ag����Mg2����Ba2�� CO32-��2H��=CO2����H2O
������ | NO3- | CO32- | Cl- | SO42- |
c/mol��L��1 | �� | 0.25 | 0 | 0.4 |
���ڣ���СŨ��Ϊ0.8mol��L��1
��������
����������ҺΪ������Һ����֪����Һ�к��е�����һ���ܹ��������棻��ʵ����֪���μ�����ϡ����ų���״����0.56L��ɫ���壬�����Һ��һ������CO32-����Ũ��Ϊ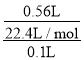 =0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ
=0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ![]() =0.4mol��������Һ�еμ���������Һ������������˵����Һ����Cl-���ٽ�ϵ���غ�������ɡ�
=0.4mol��������Һ�еμ���������Һ������������˵����Һ����Cl-���ٽ�ϵ���غ�������ɡ�
��ʵ����֪���μ�����ϡ����ų���״����0.56L��ɫ���壬�����Һ��һ������CO32-����Ũ��Ϊ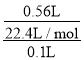 =0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ
=0.25mol/L����һ��û��Ag+��Mg2+��Ba2+�����ķ�Ӧ���Һ�м�����������ᱵ��������ɫ�������Գ���ϴ�ӡ�����������ù�������Ϊ9.32�ˣ��˳���ΪBaSO4�����ʵ���Ϊ![]() =0.04mol��������Һ�еμ���������Һ������������˵����Һ����Cl-��
=0.04mol��������Һ�еμ���������Һ������������˵����Һ����Cl-��
(1)�ɷ���֪��ʵ�����ȷ��һ�������ڵ�������Ag+��Mg2+��Ba2+��
(2)ʵ����е���ϡ�������ɵ�����ΪCO2��������Ӧ�����ӷ���ʽΪCO32-��2H��=CO2����H2O��
(3)�з���֪����Һ��һ�����е���������CO32-��SO42-��һ��������Cl-�����ж��Ƿ����NO3-���Ҹ���ԭ���غ��֪��CO32-��Ũ��Ϊ0.25mol/L��SO42-��Ũ��Ϊ![]() =0.4mol/L��
=0.4mol/L��
(4)�������ϼ����֪������ȷ��NO3-��c(CO32-)=0.25mol/L��c(SO42-)=0.4mol/L��һ��������Cl-������c(Cl-)=0�����ݵ���غ�2c(CO32-+)+2c(SO42-)=2��0.25mol/L+2��0.4mol/L=1.3mol/L��0.5mol/L�������Һ��һ������K+������Ũ������Ϊ0.8mol/L��

 ��������������������ϵ�д�
��������������������ϵ�д�