题目内容
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
分析 A、C2H6O可能为乙醇,也可能为二甲醚;
B、求出甲基的物质的量,1mol甲基含9mol电子;
C、1molCO2和乙炔中均含2molπ键;
D、CO2气体与Na2O2反应,增重的是CO的质量,且每当有2molCO2气体参与反应,增重2molCO的质量,转移2mol电子.
解答 解:A、46gC2H6O的物质的量为1mol,而C2H6O可能为乙醇,也可能为二甲醚,当为二甲醚时,1mol C2H6O含6molC-H键,故A错误;
B、-14CH3的摩尔质量为17g/mol,故17g甲基(-14CH3)的物质的量为1mol,而1mol甲基含9mol电子,故B正确;
C、标况下,11.2LCO2和乙炔的混合气体的物质的量为0.5mol,而1molCO2和乙炔中均含2molπ键,故0.5mol混合气体中含1molπ键,故C正确;
D、CO2气体与Na2O2反应,增重的是CO的质量,且每当有2molCO2气体参与反应,增重2molCO的质量,转移2mol电子,故当增重28g时,增重的是CO的物质的量n=$\frac{28g}{28g/mol}$=1mol,转移了1mol电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.高中阶段我们相继学习了同位素、同素异形体、同分异构体、同系物的概念,下列有关这四个概念说法不正确的是( )
| A. | 因为C2H6与C3H8互称同系物,所以C4H8与C6H12一定互称同系物 | |
| B. | 氕、氘、氚互称同位素 | |
| C. | O2与O3、红磷与白磷、金刚石与石墨互称同素异形体 | |
| D. | 邻二甲苯、间二甲苯、对二甲苯互称同分异构体 |
9.已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A. | Y、Z、X、W的原子序数依次减小 | |
| B. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 | |
| C. | 由W、X、Y、Z四种元素组成的化合物可能显强酸性 | |
| D. | W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同 |
16.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
| A. | 溶液中2c(Na+)=c(SO42-) | B. | 0<沉淀的物质的量<$\frac{a}{2}$ mol | ||
| C. | 沉淀的物质的量$\frac{a}{2}$ mol | D. | 原溶液中c(H2SO4)=$\frac{a}{2}$ mol•L-1 |
6.如图所示图象,不能正确反映其对应变化关系的是( )
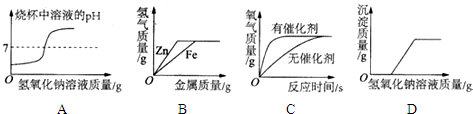

| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
10.一定温度下,反应 N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容,充入He | D. | 恒压,充入He |
11.a b c d四个集气瓶中装有Cl2 H2 HCl HBr的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现红棕色液滴,则a b c d瓶气体是( )
| A. | Cl2 HBr HCl H2 | B. | Cl2 HCl HBr H2 | C. | H2HBr HCl Cl2 | D. | H2 HCl HBr Cl2 |