题目内容
13.(1)写出表示含有8个质子、10个中子的原子的化学符号: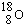
(2)最外层电子数为次外层电子数1/2的原子Li或Si;(填元素符号)
(3)根据下列微粒回答问题:
${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、14C、14N、16O、35Cl2、37Cl2、
①以上8种微粒共有6种核素,共5种元素.
②互为同位素的是${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H.
③质量数相等的是14C和14N,中子数相等的是14C和16O.
(4)相同物质的量的14CO2与S18O2的质量之比为23:34;中子数之比为2:3;电子数之比为11:16.
分析 (1)质子数=原子序数,质子数+中子数=质量数,根据原子表示法来回答;
(2)根据核内质子数=核外电子数,某元素的最外层电子数为次外层的电子数的$\frac{1}{2}$倍,最外层不大于8个电子,次外层不大于18个电子,以此进行判断;
(3)①质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
②质子数相同,而中子数不同的原子,互称为同位素;
③原子符号左上角的数字为质量数;中子数=质量数-质子数;
(4)根据m=nM计算相同物质的量的14CO2与S18O2的质量比,14CO2与S18O2每个分子都含有2个O原子,分别含有1个碳原子和1个硫原子,1个碳原子含8个中子、6个质子,1个硫原子含有16个质子,16个中子,14CO2中1个氧原子含有8个质子,8个中子,1个S18O2中1个氧原子含有8个质子、10个中子.
解答 解:(1)质子数=原子序数,质子数决定元素种类,所以含有8个质子的元素是O,并且质子数+中子数=质量数,所以该元素的质量数是18,表示为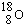 ,
,
故答案为: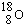 ;
;
(2)元素原子的原子核外第一层电子数只能为2,最外层电子数为次外层的电子数的$\frac{1}{2}$倍,原子核外有两个电子层,核外电子数为2+1=3,为Li,原子核外有三个电子层,核外电子数为2+8+4=14,为Si,
故答案为:Li;Si;
(3)①质子数和中子数只要其一不相同就属于不同核素:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、14C、14N、16O分别为一种核素,共6种,${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、都属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,
故答案为:6;5;
②${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H;
③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,
故答案为:14C;14N; 14C;16O;
(4)根据m=nM,相同物质的量的14CO2与S18O2的质量比为摩尔质量比即46:68=23:34,14CO2中1个碳原子含8个中子、6个质子,1个氧原子含有8个质子,8个中子,
1个14CO2中含中子数为24,含质子数为22,S18O2中1个硫原子含有16个质子,16个中子,1个氧原子含有8个质子、10个中子,1个S18O2中含中子数为36,含质子数为32,所以相同物质的量的14CO2与S18O2的中子数之比为24:36=2:3,分子质子数等于电子数,所以两者电子数之比为22:32=11:16,
故答案为:23:34;2:3;11:16.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及核外电子数的计算,注意(4)原子符号左上角的数字,题目难度不大.

| A. | 燃放焰火 | B. | 霓虹灯广告 | C. | 燃烧蜡烛 | D. | 平面镜成像 |
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
| A. | 质子数 | B. | 中子数 | C. | 核外电子数 | D. | 质子数和中子数 |
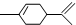 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )| A. | 萜二烯属于芳香烃 | B. | 萜二烯难溶于水 | ||
| C. | 萜二烯能发生加聚反应 | D. | 萜二烯能使酸性高锰酸钾溶液褪色 |
| A. | 金属钠与水的反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
| A. | KF | B. | NaBr | C. | LiI | D. | KCl |
| A. | ${\;}_{15}^{30}P$→${\;}_{14}^{30}Si$+x | B. | ${\;}_{7}^{14}N{+}_{0}^{1}n$→${\;}_{6}^{14}C$+x | ||
| C. | ${\;}_{27}^{60}Co$→${\;}_{28}^{60}Ni$+x | D. | ${\;}_{13}^{27}Al{+}_{2}^{4}He$→${\;}_{15}^{30}P$+x |