题目内容
12.高中阶段我们相继学习了同位素、同素异形体、同分异构体、同系物的概念,下列有关这四个概念说法不正确的是( )| A. | 因为C2H6与C3H8互称同系物,所以C4H8与C6H12一定互称同系物 | |
| B. | 氕、氘、氚互称同位素 | |
| C. | O2与O3、红磷与白磷、金刚石与石墨互称同素异形体 | |
| D. | 邻二甲苯、间二甲苯、对二甲苯互称同分异构体 |
分析 A、C4H8与C6H12均具有1个不饱和度,可以形成双键也可以形成环;
B、具有相同质子数和不同中子数的一类原子互称为同位素;
C、同一种元素的不同种单质互称为同素异形体;
D、分子式相同,结构不同的互称为同分异构体.
解答 解:A、C2H6与C3H8一定互称同系物,均为饱和烷烃,C4H8与C6H12不一定定互称同系物,因为两者一个可以是烯烃、一个也可是环烷烃,故A选;
B、氕、氘、氚质子数相同,均为1,中子数不同,互称同位素,故B不选;
C、O2与O3均是O元素形成的不同单质、红磷与白磷均是P元素形成的不同单质、金刚石与石墨均是C元素形成的不同单质,均互称同素异形体,故C不选;
D、邻二甲苯、间二甲苯、对二甲苯分子式相同,结构不同,互称为同分异构体,故D不选,故选A.
点评 本题主要考查的是同分异构体、同位素、同素异形体、同系物的概念,难度不大,注意此四种概念的区别.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
2.下列叙述正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | NCl3的电子式为 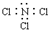 | ||
| C. | 甲酸乙酯的结构简式:C2H5OOCH | D. | 次氯酸的结构式H-Cl-O |
3.下列现象中所发生的现象与电子的跃迁无关的是( )
| A. | 燃放焰火 | B. | 霓虹灯广告 | C. | 燃烧蜡烛 | D. | 平面镜成像 |
20.用铝热法还原下列氧化物,制得金属各1mol,消耗铝最少的是( )
| A. | MnO2 | B. | WO3 | C. | Fe2O3 | D. | V2O5 |
7.用下列装置制取并收集NO2气体,其中最合理的是( )
| A. | 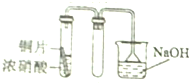 | B. | 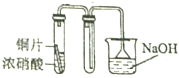 | ||
| C. |  | D. | 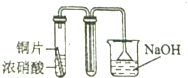 |
4.常温下,下列关系正确的是( )
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
2.下列化合物,阳离子与阴离子半径之比最小的是( )
| A. | KF | B. | NaBr | C. | LiI | D. | KCl |
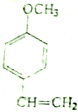 最多能与4mol的氢气发生加成反应;与溴水反应生成物的结构简式为
最多能与4mol的氢气发生加成反应;与溴水反应生成物的结构简式为 .
.