题目内容
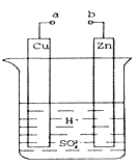
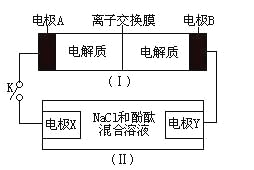
【题目】如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3![]() K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
【答案】D
【解析】
当闭合开关K时,电极X附近溶液先变红,电极X为阴极,电极Y为阳极,装置(I)放电时电极A为负极,电极B为正极;
A.原电池中阳离子向正极移动,则K+从左向右通过离子交换膜,A错误;
B.放电时的反应为2K2S2+KI3=K2S4+3KI,电极A为负极,电极A上发生失电子的氧化反应,电极反应为2S22--2e-=S42-,B错误;
C.电极X为阴极,电极X的电极反应式为2H2O+2e-=H2↑+2OH-,C错误;
D. 放电时的反应为2K2S2+KI3=K2S4+3KI,当有1mol电子通过电路时有1molK+通过离子交换膜,当有0.1molK+通过离子交换膜,电路中通过电子物质的量为0.1mol,根据电极X的电极反应式为2H2O+2e-=H2↑+2OH-,X电极上产生气体物质的量为0.05mol,该气体在标准状况下的体积为0.05mol×22.4L/mol=1.12L,D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)表中最活泼的金属是___________,非金属性最强的元素是____________。(填写元素符号,下同)
(2)表中能形成两性氢氧化物的元素是_______________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:___________、___________。
(3)⑨最高价氧化物对应水化物的电子式______________。
(4)利用下图装置来验证同主族元素非金属性的变化规律:
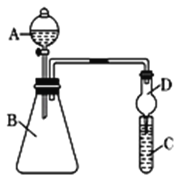
要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量____(选填下列字母:A 浓盐酸 、B 浓NaOH溶液、C 饱和Na2CO3溶液 、D 饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是_____.