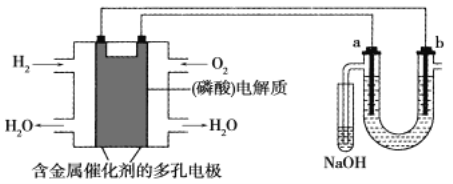
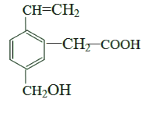
题目内容
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为____________________。
(2)AlCl3可作反应的催化剂。

①1 mol对甲基苯乙酮分子中含有的σ键数目为__________。
②CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为_______________。
(3)用价层电子对互斥理论解释SO![]() 的键角大于SO
的键角大于SO![]() 的原因是_______________。
的原因是_______________。
(4)某遮光剂的晶胞如图所示,由晶胞可知n=________。

(5)Na3[Co(NO2)6]常用作检验K+的试剂, 配位体![]() 的中心原子的杂化形式为______, 空间构型为_____。
的中心原子的杂化形式为______, 空间构型为_____。
大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ,则
,则![]() 中大π键应表示为__________。
中大π键应表示为__________。
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若该晶体的密度是ρg·cm-3,则两个最近的Fe原子间的距离为______cm。(阿伏加德罗常数用NA表示)

【答案】1s22s22p63s23p63d3或[Ar]3d3 20NA CH3COOH分子与H2O分子间形成氢键 两种离子的中心硫原子均为sp3杂化, ![]() 中没有孤对电子,
中没有孤对电子,![]() 有一个孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6 sp2 V形
有一个孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小 6 sp2 V形 ![]()
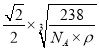
【解析】
根据原子的电子排布式分析其离子的价电子排布式。根据分子中原子的成键特点分析其σ键数目。根据分子结构分析其形成氢键的可能性。根据价层电子对互斥理论比较不同分子中键角的大小关系。根据均摊法和电离守恒分析晶胞的组成及化学式,并进行相关的计算。
(1)Cr为24元素,根据能量最低原理和洪特规则可知,其基态核外电子排布式为1s22s22p63s23p63d54s1,因此, Cr3+基态核外电子排布式为1s22s22p63s23p63d3。
(2)①对甲基苯乙酮分子中有9个C—C键、1个C=O键、10个C—H键,其分子中共有20个σ键,因此,1 mol对甲基苯乙酮分子中含有的σ键数目为20NA。
②若溶质与水分子间可以形成氢键,则溶质在水中的溶解度通常都会很大。由于CH3COOH与H2O的分子中均有羟基,两者具备形成分子间氢键的基本条件,因此,CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为CH3COOH分子与H2O分子间形成氢键。
(3)根据价层电子对互斥理论可知,当中心原子的杂化方式相同时,孤电子对越多,共价键的键角就越小。SO![]() 和SO
和SO![]() 的中心原子的价层电子对数均为4,中心原子的杂化方式均为sp3杂化,前者没有孤电子对,后者有一个孤电子对,因此, SO
的中心原子的价层电子对数均为4,中心原子的杂化方式均为sp3杂化,前者没有孤电子对,后者有一个孤电子对,因此, SO![]() 的键角大于SO
的键角大于SO![]() 的原因是:两种离子的中心硫原子均为sp3杂化,
的原因是:两种离子的中心硫原子均为sp3杂化, ![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小。
有一对孤对电子,孤对电子对成键电子对有排斥作用,因此键角更小。
(4)由该遮光剂的晶胞结构示意图可知,晶胞的棱边上有4个Na+,还有10个Na+位于面上,![]() 位于晶胞的顶点和体心,根据均摊法可以计算出该晶胞中共有6个Na+和2个
位于晶胞的顶点和体心,根据均摊法可以计算出该晶胞中共有6个Na+和2个![]() ,根据电荷守恒可知,2(n-3)=6,所以n=6。
,根据电荷守恒可知,2(n-3)=6,所以n=6。
(5)Na3[Co(NO2)6]的 配位体![]() 的中心原子为N原子,其价层电子对数为(5+1)÷2=3,故其杂化形式为sp2,由于其只形成了2个σ键, 有一个孤电子对,根据价层电子对互拆理论可知,其空间构型为V形。
的中心原子为N原子,其价层电子对数为(5+1)÷2=3,故其杂化形式为sp2,由于其只形成了2个σ键, 有一个孤电子对,根据价层电子对互拆理论可知,其空间构型为V形。![]() 中的N原子除去形成σ键的2个电子和1个孤电子对外,还剩余一个p轨道的电子;每个氧原子的p轨道有两个不成对电子,在与N原子形成一个σ键后,还剩余一个未成对的电子;另外
中的N原子除去形成σ键的2个电子和1个孤电子对外,还剩余一个p轨道的电子;每个氧原子的p轨道有两个不成对电子,在与N原子形成一个σ键后,还剩余一个未成对的电子;另外![]() 带一个单位的负电荷,说明还得到一个电子。综上所述,
带一个单位的负电荷,说明还得到一个电子。综上所述,![]() 共有3个原子和4个电子参与形成了大π键,故其中的大π键应表示为
共有3个原子和4个电子参与形成了大π键,故其中的大π键应表示为![]() 。
。
(6)根据晶胞结构示意图可知,该晶胞中有的Fe原子分布在顶点和面心,N原子在体心,根据均摊法可知,该晶胞共占有4个Fe原子和1个N原子,故其化学式为Fe4N,1mol该晶胞的质量为(564+14)g,设晶胞的边长为a,则1mol该晶胞的体积为NAa3。若该晶体的密度是ρg·cm-3,则![]() ρg·cm-3,解之得a=
ρg·cm-3,解之得a=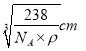 。在该晶胞中,位于顶点和面心的两个Fe原子之间的距离最近,因此两个最近的Fe原子间的距离为面对角线的一半,即
。在该晶胞中,位于顶点和面心的两个Fe原子之间的距离最近,因此两个最近的Fe原子间的距离为面对角线的一半,即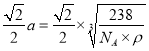 cm。
cm。