题目内容
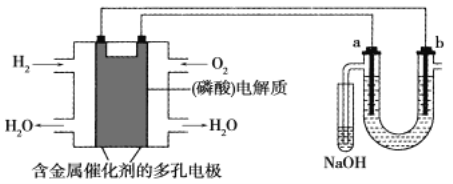
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是
A.电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B.当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
C.电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.a极的电极反应式为:2H++2e-=H2↑
【答案】B
【解析】
首先这是一个燃料电池,燃料电池一定是正极通氧气,负极通燃料,则a是阳极,b是阴极,据此来分析即可。
A.燃料电池中的电解质为磷酸,因此电极方程式中不可能出现![]() ,A项错误;
,A项错误;
B.氢气作还原剂时,1mol氢气要失去2mol电子,因此当电池中消耗0.1mol氢气时,整个装置中有0.2mol电子流过,b极产生的也是氢气,因此0.2mol电子能产生0.1mol氢气,B项正确;
C.电子仅在电极和导线中移动,C项错误;
D.根据分析a极是阳极,阳极在反应中失电子,应该是![]() 失电子产生氯气,或杂质
失电子产生氯气,或杂质![]() 失电子产生溴单质,D项错误;
失电子产生溴单质,D项错误;
答案选B。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目