题目内容
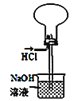
【题目】实验小组用如下图所示装置制备高铁酸钾(K2FeO4)。已知K2FeO4微溶于KOH溶液,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
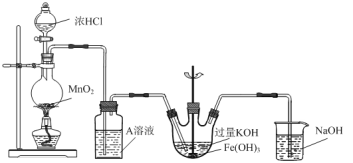
(1)A溶液的作用是__________,从平衡的角度解释用A溶液而不是水的原因:_______。
(2)写出制取K2FeO4的化学方程式:_______。
(3)实验小组测定所得样品中K2FeO4含量的方法如下:
步骤1:准确称取1.0g K2FeO4样品于锥形瓶中,加入KOH溶液和过量的NaCrO2溶液充分反应;
步骤2:向步骤1所得溶液中加入足量稀硫酸;
步骤3:向步骤2所得溶液中滴加指示剂,用浓度为0.4000 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,反应至终点时消耗(NH4)2Fe(SO4)2标准溶液体积为30.00 mL。已知测定过程中发生反应的离子方程式为:FeO![]() +CrO
+CrO![]() +2H2O=Fe(OH)3↓+CrO
+2H2O=Fe(OH)3↓+CrO![]() +OH-;2H++2CrO
+OH-;2H++2CrO![]() =Cr2O
=Cr2O![]() +H2O;H++Fe2++Cr2O
+H2O;H++Fe2++Cr2O![]() —Fe3++Cr3++H2O(未配平);
—Fe3++Cr3++H2O(未配平);
计算样品中K2FeO4的质量分数,写出计算过程_______。
【答案】除去Cl2中的HCl 由平衡Cl2+H2O![]() H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度 3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O 79.2%
H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度 3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O 79.2%
【解析】
根据反应原理及装置图分析装置中的药品及用途;根据氧化还原反应原理书写并配平反应方程式;根据滴定原理计算样品中的质量分数。
(1)浓盐酸易挥发,所以A溶液的作用是除去Cl2中的HCl,用饱和食盐水目的是降低Cl2的溶解度,原因是:由平衡Cl2+H2O![]() H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度,故答案为:除去Cl2中的HCl ;由平衡Cl2+H2O
H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度,故答案为:除去Cl2中的HCl ;由平衡Cl2+H2O![]() H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度;
H++Cl-+HClO可知,增大Cl-的浓度,可以抑制平衡的正向进行,从而减小Cl2的溶解度;
(2)根据装置中药品分析得反应物为氯气、氢氧化铁和氢氧化钾,生成物为高铁酸钾、氯化钾和水,反应方程式为:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,故答案为:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O;
(3)根据滴定过程中反应的离子方程式得出关系式:2FeO![]() ~ 2CrO
~ 2CrO![]() ~Cr2O
~Cr2O![]() ~6Fe2+,
~6Fe2+,
n( K2FeO4)=1/3n( (NH4)2Fe(SO4)2)=1/3×0.4000 mol·L-1 ×0.03L=0.004mol,则样品中K2FeO4的质量分数为![]() ,故答案为: 79.2%。
,故答案为: 79.2%。